【佳学基因检测】结直肠癌基因检测改进免疫疗法与化疗的疗效
结直肠癌基因检测
结直肠癌是中国人的第四个主要生命威胁,即是第四大最危险和最常见的dota2吧雷电竞 ,结直肠癌每年影响许多人,降低患者的生活质量,并造成无法弥补的经济和社会损失。此外,这种类型的dota2吧雷电竞 可以转移并在晚期影响肝脏。然而,目前的治疗不能完全根除这种疾病。化疗和随后的手术可以说是目前治疗这种疾病的主要方法。化疗有很多副作用,对于这种类型的dota2吧雷电竞 的治疗,化疗会导致肝损伤,如脂肪性肝炎、脂肪变性和鼻窦损伤。这些损伤最终会导致肝功能衰竭和功能丧失。因此,在dota2吧雷电竞 的精准治疗中起着信息指引的dota2吧雷电竞 正确用药基因解码认为,除了化疗之外还可以使用其他治疗方法来提高其效率并减少其副作用。生物疗法和免疫疗法是联合治疗的主要建议之一。抗体(免疫检查点阻断剂)和细胞疗法(DC 和 CAR-T 细胞)是用于治疗dota2吧雷电竞 的基于免疫系统的治疗方法之一。免疫疗法针对肿瘤的各个方面,可以通过 1) 募集免疫细胞,2) 增加肿瘤细胞的免疫原性,3) 消除肿瘤建立的抑制机制而增加治疗效果。因此,免疫疗法可以作为化疗的补充治疗。《结直肠癌基因检测改进免疫疗法与化疗的疗效》将讨论结直肠癌的不同化疗和免疫治疗方法。然后结直肠癌的正确治疗基因信息支持团队将讨论涉及联合治疗的肿瘤致病基因与正确治疗基因解码。
结直肠癌基因检测改进免疫疗法与化疗的疗效关键词
? 结直肠癌,肿瘤治疗,化疗,免疫治疗,细胞治疗
结直肠癌基因检测是基因解码基因检测的重要项目
根据《肿瘤发生风险及其精准治疗》的数据,结直肠癌 (CRC) 是男性中第三大常见癌症,女性中第二大常见癌症。此外,男性的死亡率高于女性。这种癌症在中国、欧洲、澳大利亚、北美和新西兰的发病率最高。相反,非洲和中南亚的发病率最低。饮食、环境和遗传是影响这种疾病易感性的最重要因素。根据 DNA 稳定性、突变和修复,结直肠癌 (CRC) 分为两类。第一类的特点是 DNA 错配修复 (dMMR)、高水平微卫星不稳定性 (MSI-H) 和 β2 微球蛋白 (B2MG) 表达降低(存在于 MHC-1 结构中并有助于其在细胞表面的稳定性)。第二种类型具有稳定的微卫星(MSI-L)并且错配修复能力强(pMMR)。此外,这两种类型的 结直肠癌 (CRC) 在免疫检查点配体的表达水平上有所不同,MSI-H 肿瘤具有高表达,而 MSI-L 型具有低表达的免疫检查点配体。由于这一特性,两种类型的 结直肠癌 (CRC) 对不同的免疫疗法治疗的反应不同,通过基因检测了解结直肠癌的类型对于免疫疗法至关重要。正如预期的那样,DNA 不稳定的癌症经历的修复较少,并且稳定地发生突变 。这些突变导致产生蛋白质抗原(在肿瘤细胞表面呈递的新肽),称为新抗原,其比突变较低的肿瘤具有更好的免疫原性,并表现出高水平的 DNA 修复。
此外,在另一种分类中,《肿瘤的致病基因鉴定基因检测及其治疗方法制定》叙述了四种具有区别性特征的共识分子亚型 (CMS):CMS1(微卫星不稳定性免疫,14%),高突变、微卫星不稳定且免疫激活强烈;CMS2(典型,37%),上皮性,显著的 WNT 和 MYC 信号激活;CMS3(代谢,13%),上皮性和明显的代谢失调;CMS4(间质性,23%),显著的 TGF-β 激活、基质侵袭和血管生成。具有混合特征的样本(13%)可能代表转变表型或肿瘤内异质性。因此,通过肿瘤精准用药基因解码了解结直肠癌 (CRC) 的类型对于选择适当的治疗方法非常重要。
此外,肿瘤致病基因与正确治疗基因解码结果表明,单一化疗无法完全切除肿瘤。有时,即使手术后,癌症也会复发,并可能扰乱患者的生活。因此,建议同时或联合治疗。当今备受关注的重要治疗方法之一是肿瘤免疫治疗,已显示出令人欣喜的结果。免疫治疗包括基于抗体和T细胞转移的各种治疗方法;这些是CRC免疫治疗中最关键的细胞,其使用方式有三种:不加改变地扩增、TCR基因操作和CAR-T细胞应用。此外,树突状细胞(DC)可用于治疗各种肿瘤。用于治疗肿瘤的抗体( Ab)靶向肿瘤进展的多种途径,包括血管生成、肿瘤生长、转移和免疫抑制机制,前景十分光明。用于治疗 CRC(即使是 MSS 类型)的最重要的抗体之一是免疫检查点阻滞剂,它可以抑制肿瘤细胞为抑制免疫系统而开发的途径。在《结直肠癌基因检测改进免疫疗法与化疗的疗效》中,结直肠癌的正确治疗基因信息支持团队将首先讨论已批准的化疗及其联合使用。然后结直肠癌的正确治疗基因信息支持团队将讨论各种可用的免疫疗法。最后,结直肠癌的正确治疗基因信息支持团队将讨论使用化疗和免疫疗法联合治疗结直肠癌 (CRC) 的肿瘤致病基因与正确治疗基因解码。
结直肠癌化疗
化疗是肿瘤诊断后最先采取的治疗策略之一。然而,这种治疗应根据患者的肿瘤特点进行个性化治疗。应检查的要素包括总体健康状况、肿瘤生物学(侵袭性)、化疗方案的副作用、肿瘤的左右侧性和原发部位、目前服用的药物、其他合并症以及结直肠癌重要基因的突变状态,包括与肿瘤细胞中的 RAS 和 BRAF 相关的基因。RAS 和 BRAF 基因突变可激活与细胞增殖和分化相关的细胞信号通路。肿瘤致病基因与正确治疗基因解码这些类型的突变非常重要,因为它们可能导致癌细胞对 EGFR 抑制剂治疗产生耐药性。一些已获批准的化疗药物包括 5-氟尿嘧啶、伊立替康、奥沙利铂、三氟化硫替吡嘧啶和卡培他滨。这些药物通过影响不同的细胞生长途径发挥抗肿瘤作用。然而,使用这些药物对健康细胞并非没有危害,它们有不同的副作用,结直肠癌的正确治疗基因信息支持团队将在后面讨论。
5-氟尿嘧啶(5-FU)治疗结直肠癌
5-FU(尿嘧啶类似物)是一种抗代谢药物,它将尿嘧啶 C5 位上的氟替换为氢,最终形成腺嘌呤-尿嘧啶/5-FU 碱基对。5-FU 通过易化转运机制进入细胞后,在细胞内转化为几种活性代谢物,包括 1) 氟尿苷三磷酸 (FUTP)、2) 氟脱氧尿苷三磷酸 (FdUTP) 和 3) 氟脱氧尿苷单磷酸 (FdUMP) 。5 -FU 通常通过三种机制发挥其抗肿瘤作用(由活性代谢物介导)。这种药物可以抑制胸苷酸合酶 (TS)。这种作用会破坏 DNA 复制和细胞增殖所需的细胞内脱氧核苷酸池。此外,该药物可取代细胞 RNA 中 40% 以上的尿嘧啶,导致 RNA 合成中断。此外,该药物在细胞内合成代谢后可附着在细胞 DNA 上,导致 DNA 碎片化。
自1990年以来,5-FU一直通过口服或静脉注射使用。然而,由于药代动力学差异很大且吸收难以预测,不推荐使用口服药物,并且已经放弃使用。肿瘤致病基因与正确治疗基因解码结果表明,只有3%的5-FU(处方剂量)通过合成代谢作用对癌细胞产生毒性。尽管大多数给药量的5-FU在肝脏中通过二氢吡啶脱氢酶的活性分解代谢,变成无毒无活性的代谢物。此外,肿瘤致病基因与正确治疗基因解码还表明,20%通过输注处方的5-FU会直接通过尿液排出,不会发生任何变化。
可与 5-FU 一起使用并提高其治疗效果的药物之一是亚叶酸钙 (LV) 。这两种药物同时使用可提高患者的生存率、减少副作用(化学保护)并提高 5-FU 的治疗潜力。与 5-FU 治疗应用相关的副作用分为三类。第一类与该药物对一般状况的影响有关,包括疲劳、粘膜炎、呕吐、腹泻、恶心、发热和口腔炎。第二类是其对免疫系统细胞、血细胞和其他健康细胞的影响,包括中性粒细胞减少、贫血、白细胞减少、血小板减少、皮疹和神经病变。第三类为神经系统异常,包括认知功能改变和小脑共济失调,发生率低于前两类。心脏毒性(尽管其发病机制尚未完全确定)是5-FU化疗的副作用之一,这种情况很少发生,但会严重影响患者的健康。
另外,二氢嘧啶脱氢酶(DPYD)作为一个高度多态性的基因,可能会影响氟嘧啶类药物治疗的疗效。该基因的产物是氟嘧啶代谢中的限速酶,即二氢嘧啶脱氢酶(DPD),其功能缺陷可导致氟嘧啶中毒性代谢物的蓄积。调查显示,在接受标准剂量氟嘧啶化疗的DPYD致病变异患者中,因治疗而死亡的风险增加。因此,考虑到该基因的变异已被一定程度地识别,建议在批准该类药物之前对该基因的变异进行基因检测。肿瘤致病基因与正确治疗基因解码结果显示,c.2194G>A是与DPYD相关的最常见的多态性,并且与中性粒细胞减少症也相关。肿瘤精准用药基因解码通过检测单核苷酸多态性(SNPs)面板来识别肿瘤致病基因与正确治疗基因解码 DPYD 变异,需要进行更多的肿瘤致病基因与正确治疗基因解码。
多项肿瘤致病基因与正确治疗基因解码结果表明,该药具有多种作用,包括引起心肌损伤的氧化应激、冠状动脉痉挛、红细胞氧转移受损引起的缺血、导致血栓形成的内皮损伤,以及引起心脏毒性和心脏组织损伤。然而,考虑到5-FU的治疗效果,无论其副作用如何,该药在许多临床试验中都与其他药物联合使用(表格1)。
表1:临床试验中化疗药物与氟尿嘧啶联合应用的例子
| 肿瘤致病基因与正确治疗基因解码名称 | 干预模式 | 参与研究人数 | 药物 | 阶段 | 日期 | NTC编号 | 主要发现 |
|---|---|---|---|---|---|---|---|
| 5FU/LV、伊立替康、替莫唑胺和贝伐单抗用于治疗 MGMT 沉默的微卫星稳定转移性结直肠癌。 | 顺序赋值 | 18 |
1. 贝伐单抗 2. 伊立替康 3. 亚叶酸钙 4. 5-氟尿嘧啶 5. 替莫唑胺 |
阶段1 | 2020 | NCT04689347 | 招募患者 |
| 二甲双胍和 5-氟尿嘧啶治疗难治性结直肠癌 | 单组作业 | 50 | 二甲双胍和氟尿嘧啶 | 阶段2 | 2013 | NCT01941953 |
1. 二甲双胍具有抗肿瘤活性。2 . 二甲双胍可减轻5-FU的副作用。 |
| mFOLFOX6 与 Dalpiciclib 联合治疗转移性结直肠癌患者(FIND) | 单组作业 | 18 |
1. 达匹西利 2. 奥沙利铂注射液 3. 亚叶酸钙 4. 5-氟尿嘧啶 |
阶段2 | 2022 | NCT05480280 | 招募患者 |
| 对接受过治疗的晚期无法手术的转移性结直肠癌 (mCRC) 患者联合使用 Magrolimab 的肿瘤致病基因与正确治疗基因解码 | 平行分配 | 135 |
1. 马格利单抗 2. 贝伐单抗 3. 伊立替康 4. 氟尿嘧啶 5. 亚叶酸钙 |
阶段2 | 2022 | NCT05330429 | 招募患者 |
| 转移性结直肠癌(RAS 野生型)接受 FOLFIR 联合西妥昔单抗一线治疗后出现反应 | 平行分配 | 550 |
1. 伊立替康 2. 亚叶酸 3. 5-氟尿嘧啶 4. 西妥昔单抗 5. 贝伐单抗 6. 卡培他滨 7. 瑞戈非尼 8. 伊立替康 125mg 9. 西妥昔单抗每周一次 |
第 3 阶段 | 2016 | NCT02934529 | 招募患者 |
| 在 m结直肠癌 (CRC) 患者 RAS/BRAF wt 组织和 RAS 突变液体活检中进行肿瘤致病基因与正确治疗基因解码,以比较 FOLF伊立替康(IRI)加 CetuxiMAb 或 BevacizumaB | 平行分配 | 280 |
1. 贝伐单抗 2. 西妥昔单抗 3. 5-氟尿嘧啶 4. 伊立替康 5:左亚叶酸钙 |
第 3 阶段 | 2021 | NCT04776655 | 招募患者 |
| 全身化疗加 HAI (FUDR) 与单独全身化疗治疗 CRCLM 的比较 | 平行分配 | 288 |
1. FUDR 2. 奥沙利铂 3. 亚叶酸钙 4. 5-氟尿嘧啶 |
第 3 阶段 | 2018 | NCT03500874 | 招募患者 |
| 一项针对转移性结直肠癌的 Avastin + 吉西他滨 + 5-氟尿嘧啶 (5FU)/亚叶酸与 Avastin + 奥沙利铂 + 5FU/亚叶酸的随机试验 | 平行分配 | 84 |
1. 吉西他滨 2. 阿瓦斯丁 3. 5-FU/亚叶酸 4. 奥沙利铂 |
阶段2 | 2009 | NCT00192075 |
1. 亚叶酸、5-氟尿嘧啶、吉西他滨 (FFG) 和 FOLFOX4 通常耐受性良好。2 . FGG 与 5-FU/亚叶酸相比没有潜在优势。 |
卡培他滨治疗结直肠癌
尽管使用 5-FU 治疗结直肠癌取得了成功,但由于该药物的半衰期短(需要多次注射)且从体内清除迅速,肿瘤致病基因与正确治疗基因解码人员正在寻找重新设计和利用该药物治疗优势的方法。2009 年肿瘤致病基因与正确治疗基因解码人员的努力结果导致了卡培他滨的发现,它是 5-FU 的前体药物,比 5-FU 具有优势。与 5-FU 不同,这种药物是口服的,通过患者的消化系统吸收后,通过连续的酶促反应转化为 5-FU,首先在肝脏中,然后在肿瘤部位(3 次反应)。胸苷磷酸化酶 (TP) 在肿瘤组织中的表达浓度较高。这种酶介导卡培他滨从 5'-脱氧-5-氟尿苷最终转化为 5-FU;因此,药物活性形式的产生优选在肿瘤组织中进行。肿瘤致病基因与正确治疗基因解码结果还表明,在接受放疗和细胞毒药物治疗后,肿瘤组织中TP表达水平增加,从而起到协同作用,帮助肿瘤消灭。
伊立替康(IRI)治疗结直肠癌
伊立替康(IRI)是一种水溶性半合成化疗药物,来源于喜树碱,1994 年在日本获批用于治疗肺癌、宫颈癌和卵巢癌。该药也用于治疗转移性结直肠癌。临床试验结果显示,伊立替康(IRI)与 5-FU/LV 联合治疗可显著提高患者生存期,而单纯 5-FU/LV 治疗组则未见明显改善。该药与奥沙利铂联合使用,可通过抑制转移改善患者病情。伊立替康耐受性良好,可延长治疗时间,对转移性CRC患者无累积毒性,可提高患者生存率和生活质量(QOL)。多项肿瘤致病基因与正确治疗基因解码表明,暴露于伊立替康的活性代谢物乙基-10-羟基喜树碱 (SN38) 在不同的人身上会出现不同的结果,并且可能导致接受该药物的患者出现严重毒性。此外,某些患者应严格控制药物剂量,包括严重肾衰竭患者和具有 UDP-葡萄糖醛酸转移酶 1A1 (UGT1A1) 多态性的患者。
IRI通常通过抑制拓扑异构酶I发挥其抗肿瘤作用,但肿瘤致病基因与正确治疗基因解码结果表明,这并不是IRI唯一的作用机制,暴露于IRI的细胞会发生广泛的基因表达变化,SN38与细胞的各种重要蛋白质相互作用,包括具有抗凋亡作用的BCL-xL(,FAS的上调,参与TP53介导的细胞死亡的小鼠双微体2同源物(MDM2),以及激活MAPK信号通路可导致癌细胞凋亡增加。IRI的排泄和药代动力学取决于多种因素,例如剂量、肝功能状态、年龄、给药时间和性别。
伊立替康(IRI)应用的副作用之一是接受治疗的患者中性粒细胞减少症(女性比男性更常见)。使用这种化疗药物有几个副作用,包括延迟和严重的腹泻、腹痛、脂肪性肝炎、患者血浆中的代谢变化(血浆中酰基肉碱、核碱基和某些氨基酸的积累)、类似的胆碱能症状、肝脏氧化应激和出汗。
奥沙利铂(Ox)治疗结直肠癌
奥沙利铂是一种铂衍生药物,通过与血浆蛋白结合分布于全身,用于治疗转移性结直肠癌。注射到患者体内的奥沙利铂约有一半通过尿液排出,但其在粪便中的排泄量微乎其微(清除率与肝功能无关)。该药的大部分副作用与铂活性物质的释放及其与 DNA 序列的结合 (通常与 GA 或 GG 结合) 有关,从而阻止健康细胞中的 DNA 修复和合成 。目前,奥沙利铂通常不单独用于治疗结直肠癌,而是与其他化疗和生物药物联合使用。例如,在三项随机临床试验中,将奥沙利铂添加到亚叶酸钙、卡培他滨和氟尿嘧啶方案中,可使疾病复发率降低 20%。
曲氟尿苷-替吡嘧啶治疗结直肠癌
从药物名称三氟尿苷/替吡嘧啶可以看出,这种药物由两部分组成。三氟尿苷是一种胸苷相关的核苷类似物,可取代DNA中的胸苷。而替吡嘧啶通过抑制胸苷磷酸化酶来增强三氟尿苷的功能。替吡嘧啶通过阻止胸苷碱基导致DNA中的三氟尿苷置换,最终阻止细胞增殖。转移性结直肠癌患者使用该药物最常见的副作用包括中性粒细胞减少、贫血、血小板减少和白细胞减少。这种药物中的三氟尿苷与5-FU的治疗用途类似,被胸苷激酶转化为单磷酸化形式。但与 5-FU 不同的是,三氟胸苷的单磷酸化形式通过与胸苷酸合酶的活性位点结合来抑制该酶的活性。 这导致细胞毒性和该酶不产生胸苷。 随后被胸苷激酶磷酸化产生三氟尿苷三磷酸,它很容易被掺入肿瘤细胞的 DNA 中(代替胸苷碱基),干扰 DNA 功能并抑制肿瘤生长。 在临床应用中,这种药物以剂量依赖性方式导致肿瘤生长受到抑制。 新肿瘤致病基因与正确治疗基因解码的结果表明,这种药物具有很高的治疗效率,使用非常方便,并且比其他化疗药物副作用少。
结直肠癌联合化疗
在很多与结直肠癌化疗相关的联合治疗中,5-FU或卡培他滨通常是主导药物,肿瘤致病基因与正确治疗基因解码结果显示卡培他滨的治疗效果比LV/5-FU的联合治疗有更佳的效果,但以5-FU为基础的化疗方案设计已经有很多年了。
在这些治疗方法中,结直肠癌的正确治疗基因信息支持团队可以提到 FOLFOX,它包括亚叶酸、5-FU 和奥沙利铂。这种组合的治疗效果优于单独使用奥沙利铂和 5-FU,但其主要机制尚不清楚。今天,这种组合似乎在影响肠道微生物群方面更有效。新肿瘤致病基因与正确治疗基因解码的 16S rRNA 基因序列分析表明,接受 FOLFOX 组合治疗的患者中Akkermansia muciniphila的丰度显著增加 。对Akkermansia muciniphila的进一步肿瘤致病基因与正确治疗基因解码表明,含有支链氨基酸 (BCAA) 的二肽是增加上述化合物抗癌活性的主要因素之一。多项肿瘤致病基因与正确治疗基因解码结果显示,CAPOX(亚叶酸、卡培他滨、奥沙利铂)及FOLFOX方案是治疗晚期结肠癌最有效的方案,不同之处在于CAPOX方案中将5FU的输注替换为卡培他滨的口服衍生物。
FOLF伊立替康(IRI)是另一种联合化疗方案,包括 400 mg/m 2 5-FU(第一天静脉推注)、600 mg/m 2 5-FU(第 1 天和第 2 天静脉注射)和 180 mg/m 2伊立替康(第 1 天静脉注射),每两周重复一次。由于5 - FU的治疗有效率低 (约 10% 至 15%),因此采用包括 FOLF伊立替康(IRI)在内的化疗药物联合治疗,可使有效率提高高达 45%。新肿瘤致病基因与正确治疗基因解码结果表明,可根据结肠癌患者的免疫系统细胞特征,尤其是 Treg/TH 比率来预测治疗结果。因此,Treg/TH 比率较高的患者对 FOLF伊立替康(IRI)治疗的反应优于比率较低的患者。此外,接受 FOLF伊立替康(IRI)治疗的患者中观察到调节性 T 细胞数量特异性减少。因此,似乎有些患者的高调节性 T 细胞数量并没有产生使肿瘤更具抵抗力的免疫压力。当这些患者面临治疗时,他们的反应更好。
卡培他滨和伊立替康联合治疗 (CAPIRI) 是另一种肿瘤致病基因与正确治疗基因解码中使用较少的化疗组合。然而,使用化疗化合物的各种结果都承认这些化合物不能根除肿瘤细胞。在他们的病例中,需要额外的治疗,包括生物或免疫治疗。表 2总结了一些已获批准的联合和单一药物化疗方案。
表 2:一些已批准的联合和单一药物化疗方案的总结。
| 化疗方案 | 注射程序 | 类型 | 成分 | 参考文献 |
|---|---|---|---|---|
| 洛基奇 | 每日静脉注射 | 单药 | 5-氟尿嘧啶(300毫克/平方米) | (111) |
| 时间差 | 每日静脉输注,共 5 天,每 28 天重复一次 | 综合 | 1. 推注亚叶酸钙 (200 mg/m2) 2. 5-FU (370 mg/m2) | (112) |
| FOLFOX-4 | 2天程序化输注 | 综合 |
1. 亚叶酸钙(200 mg/m2,第 1、2 天) 2. 5-FU 推注(400 mg/m2,第 1、2 天) 3. 持续输注 5-FU(600 mg/m2,持续 22 小时,第 1、2 天) 4. 奥沙利铂(85 mg/m2,第 1 天) |
(113) |
| FOLFOX-6 | 2天程序化输注 | 综合 |
1. 亚叶酸钙(400 mg/m2 静脉 注射,第 1 天) 2. 5-FU(400 mg/m2 静脉推注,第 1 天;然后以 1,200-1,500 mg/m2/天持续输注,共 2 天) 3. 奥沙利铂(100 mg/m2 静脉注射,第 1 天) |
(113) |
| 福尔菲里 | 2天程序化输注 | 综合 |
1. 亚叶酸钙(400 mg/m2 静脉注射,第 1 天) 2. 5-FU(400 mg/m2 静脉推注,第 1 天;然后以 1,200-1,500 mg/m2/天持续输注 × 2 天) 3. 伊立替康(180 mg/m2 静脉注射,第 1 天) |
(114) |
| 福福昔利 | 2天程序化输注 | 综合 |
1. 伊立替康 (165 mg/m2,60 分钟内输注) 2. 奥沙利铂 (85 mg/m2) 3. 亚叶酸钙 (200 mg/m2,120 分钟内输注) 4. 5-FU (3200 mg/m2,持续输注 48 小时) |
(115) |
| 卡培他滨 | 第 1 至 14 天,每天两次 | 单药 | 卡培他滨(1000~1250 mg/ m2) | (116) |
| CAPOX/XELOX | 第 1 至 14 天,每天两次 | 综合 |
1. 卡培他滨(1,000 mg/m2,每日两次,口服,共 14 天) 2. 奥沙利铂(130 mg/m2,静脉注射,第 1 天) |
(117) |
| 韓萊 | 每天,第 1 至 14 天 | 综合 |
2. 伊立替康 200 mg/m2(第 1 天) 1. 卡培他滨 1,600 mg/m2/天(第 1-14 天), |
(118) |
结直肠癌的生物治疗
许多生物治疗与免疫治疗直接相关,因为负责其功能的是抗体或其衍生物;然而,在本节中,结直肠癌的正确治疗基因信息支持团队将讨论可能影响肿瘤生物学的药物。目前,三种生物制剂也被视为免疫制剂,包括抗 VEGF-A 抗体贝伐单抗、抗 EGF 受体抗体西妥昔单抗和抗 EGFR 抗体帕尼单抗,后者已被批准用于转移性结直肠癌的一线治疗。这些抗体通过阻断生长受体的功能来阻止癌细胞增殖。对于 RAS 突变与 BRAF V600E 突变相关的 结直肠癌 (CRC) 患者,贝伐单抗是唯一可以与化疗一起提高治疗效率的药物。此外,帕尼单抗和其他抗 EGFR 抗体的应用仅限于 RAS 突变的肿瘤。因此,了解肿瘤类型和特性有助于选择合适的生物制剂治疗。
除了已获批准的生物疗法外,肿瘤致病基因与正确治疗基因解码人员目前还在寻找治疗结直肠癌 (CRC) 的新型生物药物。各种肿瘤最关键的一个方面是间质-上皮转化。这种现象是由肝细胞生长因子 (HGF) 与其酪氨酸激酶受体 c-MET 结合促成的。阻断这一途径尤为重要,因为间质-上皮转化在转移中起着重要作用。因此,正在肿瘤致病基因与正确治疗基因解码的生物药物对这一途径至关重要。这些药物包括奥那珠单抗、替凡替尼、沃利替尼和卡博替尼。然而,使用生物疗法并非没有副作用。例如,使用贝伐单抗可能会产生严重的副作用,如蛋白尿、伤口愈合受损、高血压、动脉(但不是静脉)血栓栓塞事件、肠穿孔、出血和白质脑病。
由于生物治疗与免疫治疗有相当大的重叠,因此它们通常被归为一类。然而,由于这些治疗直接影响肿瘤细胞的生物学,而不影响免疫系统的反应,因此被称为生物治疗。
结直肠癌免疫治疗
先前肿瘤致病基因与正确治疗基因解码的结果表明,增加T细胞对结直肠肿瘤的渗透可以控制肿瘤的生长。在识别MHC-肽复合物并在共刺激信号存在的情况下,T细胞识别肿瘤细胞并使用不同的方法摧毁它们,包括释放颗粒(细胞毒性T淋巴细胞)。在不断的挑战中,肿瘤细胞在体内建立并被免疫系统的细胞摧毁。当免疫细胞无法摧毁恶性或肿瘤细胞时,悲剧就开始了。肿瘤的一个重要点是它的微环境。随着癌症的进展,它会进化以抑制免疫系统的反应。不同类型的肿瘤采用不同的机制,但例如,它们可以降低 MHC-1 分子的表达,降低共刺激分子的表达,增加生长因子的表达,并增加抗炎细胞因子和抑制性表面分子(CTLA-4、TIM-3、PD-1、PD-L1、LAG-3 和 A2AR)的表达。此外,肿瘤细胞会将细胞外囊泡(EV)分泌到肿瘤环境中,到达免疫系统细胞并破坏其功能。因此,即使肿瘤细胞被化疗破坏,也必须有一个强大的免疫系统来清除死亡细胞并用其能力消灭剩余的肿瘤细胞。
因此,肿瘤免疫治疗的重要性日益增加(表3肿瘤免疫治疗可分为几个部分,被动免疫治疗通过转移抗体(天然或工程化)mRNA和细胞因子实现,主动免疫通常通过转移与免疫系统相关的细胞实现,包括树突状细胞(DC)和T细胞。
表3:FDA 批准的结肠直肠癌新型治疗方法的例子
| 不 | 药品名称 | 商品名称 | 特性 | 疾病 | 核准日期 | 参考文献 |
|---|---|---|---|---|---|---|
| 化疗 | ||||||
| 1 | 盐酸伊立替康 | 坎普托沙尔 | DNA拓扑异构酶I抑制剂 | 转移性结直肠癌 | 1996 年 6 月 14 日 | |
| 2 | 奥沙利铂 | 乐沙汀 | 有机铂烷化剂 | 结直肠癌(与亚叶酸钙和 5-FU 联合使用) | 2002 年 8 月 9 日 | |
| 被动免疫治疗(基于抗体) | ||||||
| 3 | 西妥昔单抗 | 爱必妥 | EGFR靶向mAb | 结直肠癌 | 2004 年 2 月 12 日 | |
| 4 | 贝伐单抗 | 阿瓦斯丁 | VEGF-A 靶向 mAb | 结直肠癌 | 2004 年 2 月 26 日 | |
| 5 | 帕尼单抗 | 维克替比 | EGFR靶向mAb | 结直肠癌 | 2006 年 9 月 27 日 | |
| 6 | 帕博利珠单抗 | 可瑞达 (Keytruda) | PD-1靶向抗体 | 结直肠癌(针对 dMMR 和 MSI-H 类型) | 2017 年 5 月 23 日 | |
| 7 | 尼沃单抗 | 奥狄沃 | PD-1靶向抗体 | 结直肠癌(针对 dMMR 和 MSI-H 类型) | 2017 年 1 月 8 日 | |
| 8 | 耶尔沃伊 | 伊匹单抗 | CTLA-4靶向抗体 | 结直肠癌(针对 dMMR 和 MSI-H 类型) | 2018 年 10 月 7 日 | |
结直肠癌被动免疫治疗
MSI-H 肿瘤通常会经历免疫细胞浸润,包括 TCD4 +(TH1)细胞和 TCD8 +;然而,免疫细胞在功能上无反应。这些细胞(存在于肿瘤基质中)通常表达免疫检查点,如 PD-1 和 CTLA-4,它们与肿瘤细胞表面的配体(如 PD-L1 和 CD28)结合并抑制免疫细胞的功能,尤其是 T 细胞。此外,如前所述,通过降低 β2MG 的表达,这些肿瘤在肿瘤细胞表面表达低水平的稳定 MHC-1,并逃避被 TCD8 +细胞识别。然而,MSI-L 结直肠癌的免疫细胞浸润到肿瘤基质中较少,并且 PD-1 表达(免疫细胞)和 PD-L1 表达(肿瘤细胞)的水平较低。因此,基于肿瘤类型的抗体(称为免疫检查点阻滞剂 (ICb))似乎可在治疗 MSI-H 肿瘤方面比治疗 MSI-L 肿瘤方面发挥更大作用。
除了上述分类的重要性之外,结直肠癌还有另一种分子分类(共识分子亚型 (CMS)),了解这些特征对于选择免疫治疗类型非常重要。从分子角度来看,结直肠肿瘤分为四组。这种划分同时考虑了在上述不同环境下肿瘤和免疫细胞的主要基因表达变化。CMS1 是一组出现许多突变的 结直肠癌 (CRC) 。它们与 MSI-H 型同义,在这些肿瘤中经常观察到与 BRAF 基因相关的突变,包括大约 1/7 的结直肠肿瘤。CMS2 也称为典型类型,约占 1/3 的 CRC,与激活 Wnt 和 Myc 信号通路的突变有关。 CMS3 肿瘤又称为代谢型,占结直肠肿瘤的 1/7,此类肿瘤常具有 KRAS 相关突变,会破坏癌细胞的代谢途径。CMS3 型和 CMS4 又称为间质型,占结直肠肿瘤的 1/4,与生长因子-β (TGF-β) 途径激活、基质活化增加、血管生成和炎症浸润有关。
这些分类的重要性在于,每个类别的肿瘤微环境都不同,因此需要不同的治疗方法。在免疫方面,CMS2 和 CMS3 肿瘤被称为冷肿瘤,其免疫系统反应处于非常低的水平,事实上,针对这些肿瘤的免疫反应尚未得到很好的建立。然而, CMS1和CMS4肿瘤被称为热肿瘤,其免疫反应比前面几组更高。但值得注意的是,CMS1 和 CMS4 由于其免疫治疗指数的特点而表现出不同的治疗反应。如前所述,CMS1 组与 MSI-H 相似,为富含 CD8 +和 CD68 +巨噬细胞的弥漫性免疫肿瘤浸润淋巴细胞 (TIL),而 CMS4 肿瘤的免疫浸润模式不同,包括单核细胞衍生细胞、调节性 T 细胞 (Treg)、MDSC 和 TH17 细胞。CMS4 型免疫抑制的主要因素是 TGF-β 的产生及其相关机制。将选择性 TGFβ 抑制剂与免疫检查点阻滞剂相结合的治疗策略可以在这些结肠癌模型中重新激活强烈的免疫反应。
除了在抑制免疫检查点方面发挥作用的抗体外,其他抗体,包括针对 TGF-β 等细胞因子的抗体,也可以降低对肿瘤相关免疫反应的抑制。此外,针对特定肿瘤抗原的抗体有时可用于提高先天免疫系统对肿瘤细胞的识别。在这种模型中,抗体附着于肿瘤细胞可通过抗体依赖性细胞毒性 (ADCC)(由巨噬细胞和 NK 细胞执行)和补体介导的细胞毒性 (CDC) 等机制导致肿瘤细胞凋亡。
结直肠癌主动免疫治疗
主动免疫治疗通常通过细胞转移进行,使用 T 细胞和树突状细胞 (DC) 进行治疗。T 细胞的使用有 3 种方式。在第一种情况下,从肿瘤部位收集肿瘤浸润淋巴细胞 (TIL),扩增,并作为自体移植物注射到患者体内。这一作用导致肿瘤特异性 T 细胞数量增加。在第二种 T 细胞疗法中,使用基因工程方法改变 T 细胞受体 (TCR),使其识别与肿瘤细胞相关的抗原的能力增强。另一种备受关注的方法是使用带有嵌合抗原受体的 T 细胞 (CAR-T 细胞) 。在这种技术中,通常使用识别肿瘤特异性或相关抗原 (TSA 或TAA ) 的抗体的 Scfv 部分及其与参与 T 细胞活化信号传递的不同胞内结构域的组合。
在某些情况下,CAR 的细胞外部分由受体的不同部分组成,该受体的配体在肿瘤细胞中大量产生。然而,CAR-T 的应用有各种局限性,它是癌症治疗中一个充满活力的领域,仍在肿瘤致病基因与正确治疗基因解码中。基于 CAR-T 细胞的治疗通常用于临床试验肿瘤致病基因与正确治疗基因解码(表4)。
表4:CAR-T 细胞临床试验作为结直肠癌新疗法的例子
| 肿瘤致病基因与正确治疗基因解码名称 | 干预模式 | 预计入学人数 | 抗原 | 路线 | 阶段 | 剂量 | 日期 | NTC编号 | 主要发现 |
|---|---|---|---|---|---|---|---|---|---|
| NKG2D CAR-T 细胞治疗已接受治疗的肝转移性结直肠癌患者 | 顺序赋值 | 9 | NKG2DL | 肝动脉输血 | 第一阶段早期 | 不适用 | 2022 | NCT05248048 | 招募患者 |
| 对无法切除的结肠直肠癌肝转移患者进行肝动脉 NKR-2 治疗 (LINK) | 顺序赋值 | 1 | NKG2DL | 肝动脉给药 | 阶段1 | 3次给药:3×10 8 –3×10 9细胞/天(3ds) | 2017 | NCT03370198 | 未发布任何结果 |
| CAR-T 肝动脉输注或胰腺静脉输注治疗 CEA 表达肝转移或胰腺癌 (HITM-SURE) | 单组作业 | 5 | 癌胚抗原 |
1. 肝动脉输注 2. 胰静脉输注 |
阶段1 | 1×1010细胞/天 | 2016 | NCT02850536 |
1. 总体生存时间增加。2 . CAR-T 安全有效地靶向表达 CEA 的 LM 并实现抗肿瘤活性。 |
| 抗 CEA CAR-T 细胞治疗结直肠癌肝转移 | 单组作业 | 18 | 癌胚抗原 | 静脉输液 | 阶段1 | 1-6×106 /千克 | 2022 | NCT05240950 | 招募患者 |
| EGFR-IL12-CART 细胞治疗转移性结直肠癌患者 (EGFRCART) | 单组作业 | 20 | 表皮生长因子受体 | 不适用 | 阶段1 | 不适用 | 2018 | NCT03542799 | 未发布任何结果 |
| EGFR CART 细胞治疗转移性结直肠癌患者 | 单组作业 | 20 | 表皮生长因子受体 | 不适用 |
第 1 阶段 第 2 阶段 |
不适用 | 2017 | NCT03152435 | 未发布任何结果 |
| 二元溶瘤腺病毒与 HER2 特异性自体 CAR-VST 联合治疗晚期 HER2 阳性实体瘤 (VISTA) | 单组作业 | 四十五 | HER2 | 肿瘤内注射 | 阶段1 | 1–100 × 10 6个细胞(1天) | 2018 | NCT03740256 | 招募患者 |
| CART133治疗复发和/或化疗难治性晚期恶性肿瘤 | 单组作业 | 20 | CD133 | 不适用 |
第 1 阶段 第 2 阶段 |
0.5~2 × 10 6细胞/千克(2ds) | 2015 | NCT02541370 |
1. 3个月疾病控制率为65.2%。2 . 重复细胞输注可提供更长的疾病稳定期 3. CART-133输注后发生CD133 +细胞消除。 |
| P-MUC1C-ALLO1 同种异体 CAR-T 细胞治疗晚期或转移性实体肿瘤 | 顺序赋值 | 100 | 粘蛋白1 | 不适用 | 阶段1 | 不适用 | 2022 | NCT05239143 | 招募患者 |
| 自体 CAR-T/TCR-T 细胞免疫疗法治疗恶性肿瘤 | 单组作业 | 73 | 肌酸激酶 | 不适用 |
第 1 阶段 第 2 阶段 |
不适用 | 2018 | NCT03638206 | 未发布任何结果 |
| αPD1-MSLN-CAR T 细胞用于治疗 MSLN 阳性晚期实体瘤 | 单组作业 | 10 | 上皮细胞 | 静脉注射 | 第一阶段早期 | 1×10 5 -3×10 6 aPD1 MSLN-CAR+ T 细胞/kg(1天) | 2020 | NCT04503980 | 未发布任何结果 |
在CRC病例中,CAR-T细胞的应用存在局限性,包括这些细胞向肿瘤部位迁移的趋化能力低、肿瘤细胞代谢造成的酸性环境、诱导性缺氧和缺乏营养。除了这些情况之外,CRC中严重的免疫抑制微环境也是治疗障碍之一。这些抑制移植CAR-T细胞的物质包括抗炎细胞因子、抗炎细胞(包括Tregs、MDSCs和肿瘤相关巨噬细胞)以及来自肿瘤细胞的代谢产物(例如IDO从色氨酸产生的犬尿氨酸)。
在徐杰等人的肿瘤致病基因与正确治疗基因解码中,他们制作了一种基于人表皮生长因子受体 2 (HER2) 的 CAR-T 细胞。这种受体也在许多健康细胞表面表达。然而,其在卵巢癌、胃癌、结直肠癌、乳腺癌和肺癌等肿瘤细胞中的表达水平更高。这项肿瘤致病基因与正确治疗基因解码表明,HER2 特异性 CAR-T 可以增加结直肠癌 (CRC) 小鼠模型中的抗肿瘤反应,并具有较高的治疗能力。
除 T 细胞外,在 TME 的影响下,DC 获得不同的功能和表型特征,导致其在抗肿瘤反应中失去功能,甚至抑制免疫反应。根据肿瘤微环境浸润的 DC(TIDC)的特点,例如其成熟水平及其与肿瘤环境中其他细胞(包括 TIL)的相互作用,它们可对结直肠癌 (CRC) 预后产生积极或消极的影响。除 TIDC 外,在结直肠癌 (CRC) 患者中,循环DC的数量和功能通常降低,未成熟或祖细胞表型也与增加有关。总体而言,可以说,大量的 TIDC(使用 S100 标记物检查)与 结直肠癌 (CRC) 的良好预后和较少的转移相关(188、189 )。肿瘤致病基因与正确治疗基因解码还表明,结直肠癌 (CRC) 中成熟 TIDC 数量越多,疾病预后越好,TH 和 CTL 反应也越好(如 MSI-结直肠癌 (CRC) 中所见)。肿瘤致病基因与正确治疗基因解码表明,表达 PD-L1 的 DCs 在治疗中使用会导致 TCD8 +细胞向 结直肠癌 (CRC) 部位的淋巴浸润增加,并与患者生存率提高有关。循环 DC 和 TIDC 都会产生细胞因子和抗炎因子,包括 VEGF、IL-10 和 TGF-β,这些因子最终会抑制 T 细胞反应。此外,在这些细胞中,一些基因的表达水平增加,包括与 COX-2 和 HMGB1 相关的基因,有助于抑制免疫系统的反应。重要的是,肿瘤细胞通过产生各种因子(如 CCL2、CXCL5、CXCL1 和 VEGF)来影响树突状细胞。因此,如果从 结直肠癌 (CRC) 患者中分离树突状细胞,并在扩增和分化后自体移植到患者体内,它们可以通过刺激 T 细胞对肿瘤产生强大的抗免疫反应。另一种方法是利用树突状细胞反应的刺激因子及其抗原的加工和呈递,通过原位施用其刺激分子,如 CpG、FLT3L、TLR 和 STING 激动剂。
结直肠癌联合治疗
考虑到TME和肿瘤细胞面对不同治疗的复杂行为,单一疗法似乎无法达到预期的效果。如前所述,肿瘤致病基因与正确治疗基因解码人员多年前就得出了这个结论,因此使用不同化疗药物的组合以及放疗和手术。随着基于免疫学和生物学的治疗方法的出现和增加,可以预防化疗的诸多副作用,这些治疗方法成为更理想的选择。因此,肿瘤致病基因与正确治疗基因解码人员有兴趣使用副作用较少的多种免疫疗法来减少化疗药物的剂量并帮助消灭肿瘤细胞。
细胞因子与化疗联合
与此同时,许多成果表明免疫治疗可增强化疗的疗效。肿瘤致病基因与正确治疗基因解码表明,5-FU 和 IFN-α 之间存在相互作用,可增加对不同癌症的细胞毒性。Laurent 等人的肿瘤致病基因与正确治疗基因解码中,5-FU 和 IFN-α 被用于治疗结直肠癌。该肿瘤致病基因与正确治疗基因解码结果表明,IFN-α 与 5-FU 联合使用,通过调节抗癌前药转化酶,增加体外结直肠癌细胞中DNA 单链和双链断裂的数量。其他肿瘤致病基因与正确治疗基因解码也表明,IFN-γ 可增加与 5-FU 合成代谢相关的酶(TP 和 UP)的活性,从而通过增加该药物的活性形式帮助清除更多的肿瘤细胞。尽管实验结果令人鼓舞,但临床肿瘤致病基因与正确治疗基因解码表明5-FU与IFN-α联合使用并不能显著影响患者的生存率或肿瘤切除率,因此停止了该药物的联合使用。
免疫检查点阻断与化疗联合治疗
根据免疫检查点阻断与化疗药物联合治疗的经验,这些药物似乎可以增强免疫系统细胞的抗肿瘤反应能力 。例如,已有肿瘤致病基因与正确治疗基因解码表明,使用 5-FU 可导致 TME 中的 MDSC 凋亡,从而消除这些细胞诱导的免疫抑制。另一方面,使用奥沙利铂可导致肿瘤细胞凋亡,导致胰腺 T 细胞出现各种抗原并被树突状细胞清除,从而增强肿瘤特异性反应。一项肿瘤致病基因与正确治疗基因解码中,使用免疫检查点阻断小鼠结肠癌模型进行的体内试验表明,奥沙利铂与免疫检查点抑制剂联合使用可诱导抗肿瘤反应,并提高该模型的生存率。此外,一项临床试验(202)使用了 5-FU 和抗 PD-L1 人源化抗体阿替利珠单抗。使用这种组合时,患者首先接受 FOLFOX 化疗组合治疗;然后接受 5-FU 和阿替利珠单抗治疗。但该肿瘤致病基因与正确治疗基因解码结果显示,添加这种治疗组合不会影响患者的无进展生存期 (PFS) 和总生存期 (OS)。
单克隆抗体与化疗联合使用
目前,大多数转移性结直肠癌患者均接受一线生物制剂治疗,通常是针对血管内皮生长因子 (VEGF) 或表皮生长因子受体 (EGFR) 的单克隆抗体,具体取决于患者的 RAS 突变基因检测结果。如图所示表 5,贝伐单抗是一种人源化抗血管生成抗体,与化疗联合用于治疗各种肿瘤的一线治疗。该抗体与其配体( VEGFR )结合可抑制新血管生成、使血管正常化,从而使T细胞能够穿透肿瘤并有效激活它们。据前文所述,FOLFOX伊立替康(IRI)与贝伐单抗(靶向 VEGF-A)联合阿替利珠单抗(靶向 PD-L1)已在与化疗联合用于一线治疗的临床试验中,并将其结果与贝伐单抗和化疗的治疗效果进行了比较。本次肿瘤致病基因与正确治疗基因解码共纳入 218 例患者,结果显示,接受联合治疗的患者的 PFS(约 13 个月)高于仅接受贝伐单抗和化疗的患者(11.5 个月)(p=0.07) 。这种变化并不显著。进一步的肿瘤致病基因与正确治疗基因解码在临床试验中将 FOLFOX 联合贝伐单抗和 nivolumab 与 FOLFOX 和贝伐单抗治疗 结直肠癌 (CRC) 进行了比较,以探讨化疗联合免疫治疗的效果。本肿瘤致病基因与正确治疗基因解码未达到 PFS 这一主要终点。然而,12 个月后,接受 FOLFOX 联合贝伐单抗和 nivolumab 治疗的患者比接受 FOLFOX 和贝伐单抗治疗的患者显示出更高的 PFS 率。此外,与FOLFOX和贝伐单抗相比,联合治疗的免疫应答率更高且更持久,这表明化疗和肿瘤腺瘤靶向治疗联合使用两种针对不同途径的抗体具有更高的治疗效率(图1)。
表 5:临床试验中以抗体为基础的免疫疗法与化疗相结合作为结直肠癌新疗法的例子
| 肿瘤致病基因与正确治疗基因解码名称 | 干预模式 | 预计入学人数 | 药品 | 阶段 | 日期 | NTC编号 | 主要发现 |
|---|---|---|---|---|---|---|---|
| LEAC-102 治疗晚期结直肠癌 | 单组作业 | 三十 | LEAC-102 500mg 胶囊和 FOLFOX+贝伐单抗/西妥昔单抗 |
第 1 阶段 第 2 阶段 |
2016 | NCT02826837 | 未发布任何结果 |
| Reolysin 与 FOLFOX6 和贝伐单抗联合治疗或 FOLFOX6 和贝伐单抗单独治疗转移性结直肠癌 | 平行分配 | 109 |
1. FOLFOX + 贝伐单抗 + Reolysin 2. FOLFOX + 贝伐单抗 |
阶段2 | 2012 | NCT01622543 | FOLFOX6/贝伐单抗中添加 Reolysin 可提高患者的总体反应率。 |
| FOLFOX+贝伐单抗联合伊立替康治疗转移性结直肠癌的疗效(CHARTA) | 平行分配 | 250 |
1. 奥沙利铂、5FU/LV、贝伐单抗 2. 5FU/LV、奥沙利铂、贝伐单抗、伊立替康 |
阶段2 | 2011 | NCT01321957 | ↑ 患者存活率。 |
| 转移性结直肠癌的序贯治疗策略(ITACa) | 平行分配 | 350 |
1. FOLF伊立替康(IRI)或 FOLFOX + 贝伐单抗 2. FOLF伊立替康(IRI)或 FOLFOX 3. FOLF伊立替康(IRI)或 FOLFOX + 西妥昔单抗 4. FOLF伊立替康(IRI)或 FOLFOX + 贝伐单抗和西妥昔单抗 |
第 3 阶段 | 2013 | NCT01878422 | 在标准一线化疗中添加贝伐单抗并未延长无进展生存期、总生存期和缓解率。 |
| 转移性结直肠癌的二线治疗(BEVATOMOX) | 平行分配 | 83 |
1. 贝伐单抗、奥沙利铂和 5FU 联合用药 2. 贝伐单抗、奥沙利铂和雷替曲塞联合用药 |
阶段2 | 2012 | NCT01532804 |
已终止 未发布结果 |
| mFOLFOX伊立替康(IRI)联合卡多利单抗 (AK104) 与 mFOLFOX6 在局部晚期结直肠癌新辅助治疗中的比较 (OPTICAL-2) | 平行分配 | 82 |
1. mFOLFOX伊立替康(IRI)+ 卡多利单抗 2. mFOLFOX6 |
阶段2 | 2022 | NCT05571644 | 尚未招募 |
| FOLFOX伊立替康(IRI)+ Bev + Atezo 与 FOLFOX伊立替康(IRI)+ Bev 作为不可切除转移性结直肠癌患者的一线治疗(AtezoTRIBE) | 平行分配 | 201 |
不同组合: 贝伐单抗 伊立替 康 奥沙利铂 L-亚叶酸钙 5-氟尿嘧啶 阿特珠单抗 |
阶段2 | 2018 | NCT03721653 | ↑ 患者无进展生存期(207)。 |
| 转移性结直肠癌 (mCRC) 的生物标志物驱动治疗肿瘤致病基因与正确治疗基因解码 (MODUL) | 平行分配 | 609 |
不同组合: 西妥昔单抗 FOLFOX 诱导方案 氟嘧啶(5-FU/LV 或卡培他滨) 阿替利珠单抗 维莫非尼 贝伐单抗 曲 妥珠 单抗 帕妥珠单抗 考比替尼 5-FU/LV |
阶段2 | 2014 | NCT02291289 | 不适用 |
| CYAD-101 联合 FOLFOX 预处理治疗转移性结直肠癌后的派姆单抗治疗肿瘤致病基因与正确治疗基因解码 | 顺序赋值 | 24 |
不同组合: CYAD-101 FOLFOX Pembrolizumab |
阶段1 | 2021 | NCT04991948 | 招募患者 |
| 化疗和免疫疗法治疗高免疫浸润的 MSS 转移性结直肠癌 (POCHI) | 单组作业 | 55 |
不同的组合: 卡培他滨 奥沙利铂 贝伐 单抗 帕博利 珠单抗 |
阶段2 | 2020 | NCT04262687 | 招募患者 |
| Tucatinib 联合曲妥珠单抗和奥沙利铂化疗或含派姆单抗的联合疗法治疗 HER2+ 胃肠道癌症 | 顺序赋值 | 120 |
不同组合: 图卡替尼 曲妥珠单抗 奥沙利铂 亚叶酸钙 氟尿嘧啶 卡培他滨 帕博利珠单抗 |
第 1 阶段 第 2 阶段 |
2020 | NCT04430738 | 招募患者 |

图1:化疗和抗体联合用于结直肠癌治疗。抗体可以通过靶向不同的肿瘤抗原发挥不同的功能。其中一些抗体,如抗PD-1抗体和抗CTLA-4抗体等免疫检查点抑制剂(A),可增加免疫细胞的反应,而另一些抗体,通过靶向特定抗原(B),导致ADCC或CDC的激活。化疗可导致肿瘤细胞凋亡,并释放来自肿瘤细胞的各种类型的抗原(C)。一方面,这些抗原的释放导致抗原呈递细胞的成熟度增加。另一方面,使用免疫检查点抑制剂可激活更多的免疫系统细胞来对付肿瘤。事实上,这些类型的治疗化合物从不同的途径影响肿瘤,并且在对肿瘤细胞进行放疗或化疗后不会使肿瘤复发。ADCC,抗体依赖性细胞细胞毒性;CDC,补体依赖性细胞细胞毒性。
在其他涉及化疗和免疫疗法联合治疗的肿瘤致病基因与正确治疗基因解码中,结直肠癌的正确治疗基因信息支持团队可以参考 GOIRC-03-2018 的 II 期肿瘤致病基因与正确治疗基因解码,该肿瘤致病基因与正确治疗基因解码将三联化疗(FOLFOXIRI)与贝伐单抗和 nivolumab 联合用于含有 RAS/BRAF 突变的 结直肠癌 (CRC) 患者。该肿瘤致病基因与正确治疗基因解码的结果表明,FOLFOX伊立替康(IRI)与贝伐单抗和 nivolumab 的联合治疗是安全的,并且已显示出有希望的结果;这就是为什么该小组继续进行 III 期肿瘤致病基因与正确治疗基因解码的原因,其结果尚未公布。此外,在另一项临床试验中,尽管 POCHI 试验(NCT04262687)目前正在肿瘤致病基因与正确治疗基因解码 CAPOX 和贝伐单抗与 pembrolizumab 联合作为符合条件的 MSS m结直肠癌 (CRC) 患者的一线治疗,这些患者具有较高的免疫浸润,并且结果预计在患者中显示良好。
西妥昔单抗是一种嵌合抗体(鼠V和人FC),是一种IgG1抗体,可通过增加ADCC和树突状细胞表面MHC-2分子的表达来增加肿瘤细胞的消除。它已被批准作为CRC患者联合治疗方案的一部分。因此,为了肿瘤致病基因与正确治疗基因解码西妥昔单抗与化疗联合治疗的有效性,采用了西妥昔单抗联合FOLFOX治疗(Ⅱ期临床试验),结果显示这种联合治疗对选定的患者具有潜在的治疗效果。与西妥昔单抗和FOLFOX联合治疗应用相关的Ⅲ期临床试验( TAILOR肿瘤致病基因与正确治疗基因解码)的结果表明,所有相关的临床目标和终点均已达到,西妥昔单抗联合FOLFOX是批准用于mCRC患者的有效的标准一线治疗方案。另外,一项肿瘤致病基因与正确治疗基因解码调查了在 FOLFOX 和西妥昔单抗中添加阿维单抗的治疗效果,结果表明这种添加没有特定的不良反应。但是,在上述组合中添加阿维单抗并未达到其第一个终点,患者病情没有显著改善。
CAR-T细胞与化疗的联合应用
看来,通过调节血液白细胞的表型和丰度,化疗可以促进最有效的 CAR-T 细胞产品的产生。此外,通过增加循环 CD8+ T 淋巴细胞的活性并重建有效记忆细胞群,化疗可以增强免疫系统反应。然而,化疗对其他免疫系统细胞(如中性粒细胞)的影响是有害的,有时会导致中性粒细胞减少症。此外,各种肿瘤致病基因与正确治疗基因解码的结果显示,化疗对 TCD4 +细胞的影响尚无定论(图 2) 。有趣的是,Bellone 等人发现,在每个疗程的顺铂、吉西他滨和 5-氟尿嘧啶联合化疗(最多 4 个周期)后,TCD8 + 细胞诱导和自发释放的 IFN-γ 与治疗前值相比没有变化,表明在整个治疗过程中效应功能得以保留。因此,在转移 CAR-T 细胞之前使用化疗似乎可以在体内为这些细胞的活性提供适当的条件。然而,在结直肠癌的正确治疗基因信息支持团队检索文献期间,直到 2023 年 3 月,没有肿瘤致病基因与正确治疗基因解码同时使用化疗药物和 CAR-T 细胞治疗结直肠癌。结直肠癌的正确治疗基因信息支持团队建议肿瘤致病基因与正确治疗基因解码人员也使用此方法治疗 CRC,因为化疗可以提高基于 CAR-T 细胞治疗的治疗效率。
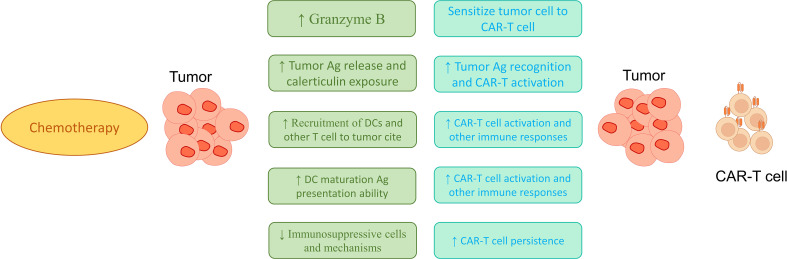
图 2:CAR-T细胞与化疗联合治疗提高疗效的可能机制如图所示,化疗可以增加免疫细胞的募集,增加树突状细胞的成熟,增加肿瘤部位免疫细胞的激活,减少免疫细胞的抑制反应,从而增加CAR-T细胞的潜在治疗功能。
结直肠癌基因检测改进免疫疗法与化疗的疗效
正如许多文章中提到的,根据活跃在肿瘤治疗领域的科学家的观点,基于药物的疗法通常无法克服肿瘤细胞产生的复杂TME。至于化疗,由于其副作用,药物剂量越低,患者的健康状况越好,副作用越少。正如《结直肠癌基因检测改进免疫疗法与化疗的疗效》中讨论的那样,肿瘤使用不同的方法和途径来克服抑制肿瘤生长的各种检查点。此外,许多肿瘤致病基因与正确治疗基因解码表明,在许多情况下,使用单一治疗方法会导致肿瘤对该治疗产生耐药性。例如,癌细胞可以通过表达一些膜泵并产生对给定治疗有耐药性的新肿瘤细胞株来对化疗药物产生耐药性。此外,使用针对免疫检查点的抗体(例如,抗PD-1抗体)可导致肿瘤细胞表面其他免疫检查点的补偿性表达(LAG-3表达)。因此,似乎同时针对与肿瘤诱导的生长和免疫抑制相关的几种不同机制的联合治疗可以对肿瘤的治疗大有帮助。结直肠癌的正确治疗基因信息支持团队知道,最终导致肿瘤根除的主要系统是免疫系统。因此,基于激活该系统更特异性地对抗肿瘤细胞的方法可以帮助更快地根除肿瘤。获得正确治疗并同时获得适当治疗的方法之一是将免疫疗法与化疗一起使用。如第 6 节所述,在许多肿瘤致病基因与正确治疗基因解码中,这种组合的使用有助于改善患者的健康状况。但值得注意的是,在某些情况下,联合治疗组和单独化疗治疗组在患者病情改善方面没有观察到显著变化。这些治疗的关键点是,文献中没有观察到化疗和 CAR-T 细胞在结直肠癌中的联合使用。虽然从理论上和临床应用中,这种组合在改善其他肿瘤患者的病情方面非常有效。似乎使用新的化合物,如小分子、化疗和免疫疗法,可以影响这种肿瘤治疗。然而,需要更多的肿瘤致病基因与正确治疗基因解码来调查联合治疗的疗效和安全性。
(责任编辑:佳学基因)



