【佳学基因检测】遗传性弥漫性胃癌的基因解码、基因检测及dota2吧雷电竞 治疗
遗传性弥漫性胃癌基因检测导读:
遗传性弥漫性胃癌是一种常染色体显性遗传综合征,其特点是弥漫性胃癌和小叶性乳腺癌的高发病率。它是由dota2吧雷电竞 抑制基因CDH1的失活突变引起的。多年来,基因检测技术变得更加高效,还能够发现其他胃癌易感基因,例如CTNNA1贼重要的基因之一。胃癌发病风险增加的致病性变异携带者的诊断是一个涉及多学科团队的选择过程。为了实现贼佳的长期结果,需要在风险管理中共同决策。遗传性弥漫性胃癌的基因解码、基因检测及靶向药物治疗根据现有文献概述了遗传性弥漫性胃癌的分子变化和当前治疗方法。
遗传性弥漫性胃癌的基因解码、基因检测及靶向药物治疗关键词
遗传性弥漫性胃癌,HDGC,CDH1,种系突变,CTNNA1,突变,基因检测
1.遗传性弥漫性胃癌知识背景介绍
遗传性弥漫性胃癌(HDGC)是一种以弥漫性胃癌(DGC)和小叶乳腺癌(LBC)高发为特征的dota2吧雷电竞 综合征。它于 1998 年新颖在新西兰毛利人家庭中被描述 。
胃癌是继肺癌、结直肠癌、乳腺癌和前列腺癌之后的全球第五大癌症死亡原因 。大约 1-3% 的胃癌是遗传性的。在全球范围内,估计遗传性弥漫性胃癌的人口发病率约为 5–10/100.000 。在过去的四年中,非贲门胃癌的总体发病率和死亡率均有所下降。然而,50 岁以下人群的发病率正在增加 。在年轻人中,胃癌与低分化和印戒细胞形态的高发生率有关。在这个患者队列中,胃癌在新颖诊断时处于晚期,即使手术切除也具有较差的生存率 。
大约 40% 的遗传性弥漫性胃癌家族在CDH1基因(钙粘蛋白 1)内表现出种系突变 。CDH1编码 E-cadherin,这是一种具有肿瘤抑制功能的同嗜性跨膜蛋白,定位于上皮组织中的粘附连接处。在正常细胞中,E-钙粘蛋白的表达对于细胞-细胞粘附、细胞机械敏感性、上皮-间质转化和细胞增殖的接触抑制信号传导至关重要 。
布莱尔等人。发表了国际胃癌关联联盟 (IGCLC) 临床管理指南的更新 。根据这些 2020 年 IGCLC 指南,遗传性弥漫性胃癌 在消化科肿瘤诊断与治疗被标准描述为在孤立的弥漫性胃癌 (DGC) 病例中存在CDH1或CTNNA1 (连环蛋白 α1)致病变异,或在新颖有两个或多个弥漫性胃癌病例的家庭中存在或二级亲属。关于遗传性弥漫性胃癌筛查,识别具有高遗传性弥漫性胃癌预测概率的患者并筛查CDH1或CTNNA1突变在临床上仍然具有挑战性。一个CDH1如果满足 IGCLC 的规定标准,建议进行测试。满足基因检测标准但发现CDH1基因突变呈阴性的个体应随后进行CTNNA1检测。
遗传性弥漫性胃癌 的临床表型在癌症的组织形态学类型和发病年龄方面表现出相当大的异质性 。晚期遗传性弥漫性胃癌的组织病理学与散发性弥漫性胃癌相当,尽管典型的前体病变、原位或 pagetoid 印戒细胞的存在对CDH1突变相关的遗传性弥漫性胃癌非常具有特异性 。早期遗传性弥漫性胃癌具有惰性表型,而晚期遗传性弥漫性胃癌表现出侵袭性表型,混合多形性细胞、增殖增加和异常 p53 表达。
如果在没有胃癌表型表现的情况下检测到CDH1突变,是否推荐手术切除或内镜控制仍存在争议。CDH1突变携带者有大约 70% 的男性患胃癌的终生风险和 56% 的女性患胃癌 。因此,应建议来自确诊遗传性弥漫性胃癌家族的CDH1变异携带者考虑预防性全胃切除术 (PTG),无论内镜检查结果如何 。建议在成年早期进行手术,一般在 20 至 30 岁之间 。PTG 不推荐用于 70 岁以上的患者,除非有明显的缓解情况。对于那些拒绝或希望推迟 PTG 的人,建议由具有遗传性弥漫性胃癌知识的有经验的内镜医师进行年度内镜检查。进行 PTG 或继续监测(内窥镜筛查和活检)的决定受到来自患者的许多不同且相互关联的因素的影响,例如客观风险确认、感知的家族性癌症负担、主观风险认知、经验和对不同风险的认知管理选择和生命阶段。
2.遗传性弥漫性胃癌的分子遗传学和组织病理学改变
2.1 驱动遗传性弥漫性胃癌的突变和癌症易感基因
如前所述,在遗传性弥漫性胃癌中已知几种驱动突变和癌症易感基因突变。CDH1突变是胃癌中贼常见的种系突变,是遗传性弥漫性胃癌综合征的基础。在全球范围内,大约 30-40% 符合遗传性弥漫性胃癌临床标准的病例携带种系CDH1基因的致病变异 。CDH1编码细胞间粘附蛋白 E-钙粘蛋白 。此外,已在不同种族中发现了几种CDH1种系突变 。
在具有强烈遗传性弥漫性胃癌家族史但没有CDH1突变的患者中,已经描述了其他遗传原因。没有致病性CDH1变异的遗传性弥漫性胃癌 患者很少见,这使得大型数据集的收集具有挑战性。一些相关基因的种系突变,例如CTNNA1、MAP3K6、INSR、FBXO24、DOT1L、CD44、PALB2、MSH2、BRCA1、RAD51C和MET对特定的遗传性弥漫性胃癌家族敏感(见表1)
表1:遗传性弥漫性胃癌中的分子谱
|
基因 |
相应的蛋白质 |
相关基因表达的癌症 |
编码函数 |
|
CDH1 |
钙粘蛋白 |
胃癌(包括遗传性弥漫性胃癌在内的弥漫型)、小叶乳腺癌、结直肠癌、肝细胞癌、皮肤、颈部和头部的鳞状细胞癌、食道癌、胰腺导管腺癌 |
肿瘤抑制因子和粘附,细胞-细胞接触中的粘附 |
|
CTNNA1 |
Alpha E-钙粘蛋白 |
遗传性弥漫性胃癌(也没有CDH1突变的遗传性弥漫性胃癌)、弥漫型 GC 和结肠直肠癌 |
肿瘤抑制因子和粘附,细胞-细胞接触中的粘附 |
|
MAP3K6 |
丝氨酸/苏氨酸蛋白激酶 |
遗传性弥漫性胃癌, |
抑癌剂 |
|
BRCA1 , PALB2 , RAD51C |
各自对应的蛋白质 |
遗传性弥漫性胃癌,乳腺癌,胰腺癌,胰腺导管腺癌 |
调节同源DNA 重组 |
|
DOT1L |
组蛋白甲基转移酶 |
DGC |
对DNA 修复的影响 |
|
MSH2 |
DNA错配修复(MMR)蛋白的代码 |
遗传性非息肉病性结直肠癌(HNPCC) |
复制后DNA 错配修复系统 (MMR)的组成部分 |
|
MET |
一种具有细胞外、跨膜和酪氨酸激酶结构域的蛋白质 |
胃癌(肠癌和弥漫型,包括遗传性弥漫性胃癌、乳腺癌、前列腺癌、卵巢癌、遗传性乳头状肾癌 |
在细胞存活、胚胎发生、细胞迁移和侵袭中的功能 |
|
CD44 |
细胞表面糖蛋白 |
增生性息肉、肠化生、胃癌(肠型和弥漫型,包括遗传性弥漫性胃癌) |
细胞表面糖蛋白 |
|
INSR |
受体酪氨酸激酶 |
遗传性弥漫性胃癌 |
对肿瘤细胞侵袭的影响 |
|
FBXO24 |
F盒蛋白 |
DGC |
肿瘤驱动 |
CTNNA1编码连环蛋白 alpha-1,一种CDH1结合伴侣。2013 年报道了先进个携带CTNNA1种系突变的遗传性弥漫性胃癌家族。从那时起,又有四个家族被报道,将CTNNA1确立为除CDH1之外的第二个遗传性弥漫性胃癌易感基因。然而,关于致病性CTNNA1变异的外显率知之甚少 。尽管如此,2020 年 IGCLC 临床标准适用并提倡除CDH1基因检测外还对CTNNA1进行基因检测的适应症。
同源重组 (HR) 修复基因的突变,例如PALB2,可能解释了遗传性胃癌 (GC)的重要部分。Fewings 等人。发现PALB2功能丧失 (LOF) 基因变异在遗传性弥漫性胃癌家族中比在一般人群中更常见 > 7.5 倍 。其风险可能受到突变热点、修饰基因和其他未考虑的环境因素的影响。幽门螺杆菌在PALB2突变携带者中的修饰作用的证据有限。
还有有限的数据表明PALB2相关的非遗传性弥漫性胃癌患者可能会从 PARP 抑制剂治疗中受益 。因此,PALB2作为一种新的家族性胃癌基因的出现,可能为胃癌的预防和靶向个性化治疗提供双重意义。
尽管全基因组测序可能会为许多没有致病性CDH1或CTNNA1变异的遗传性弥漫性胃癌家族确定调控元件或结构变异的一些额外候选者,但即使在全外显子组测序后,其潜在原因通常仍无法解释 。未来对与疾病易感性相关的基因的研究可能会集中在具有轻度至中度影响的癌症基因上,例如PALB2,以扩大个性化治疗的选择。
2.2. CDH1 种系变异谱
CDH1基因位于染色体16q22.1,由16个外显子组成。种系变体分散在整个基因中 。在遗传性弥漫性胃癌临床环境中,CDH1种系异常均匀分布在整个基因中,没有明显的基因型-表型相关性 。虽然CDH1的先进个种系突变于 1998 年在遗传性弥漫性胃癌家族中被报道 ,但目前在遗传性弥漫性胃癌中描述了100 多个CDH1其他种系突变。已知的变异主要是截短突变,通常由移码、单核苷酸变异或外显子/内含子剪接位点突变引起。。错义部分占迄今为止描述的突变的 16% 。错义突变的临床和功能影响仍然在专家中引起争议,因为在大多数情况下保留了全长蛋白质,并且通常表达正常水平的 E-钙粘蛋白。
CDH1突变仅在呈现常染色体显性家族性疾病的一个等位基因中遗传。为了启动肿瘤过程,必须诱导 CDH1 基因第二拷贝的下调或体细胞失活。表观遗传改变被认为在这个过程中发挥了重要作用。导致双等位基因 CDH1 失活的贼常见既定机制是启动子高甲基化,而第二个 CDH1 等位基因的突变或缺失很少被描述。报告的CDH1总数中约有 27%(155 人中的 41 人)已在多个家族中报道了致病性突变,这表明种系突变可能来自共同的祖先,也可能是突变热点处新事件的结果。
汉斯福德等人。描述CDH1突变携带者患 GC 和乳腺癌 (BC) 的累积风险。男性参与者 80 岁时 GC 的累积发生率为 70%,女性参与者为 56%。女性参与者的 BC 风险为 42% 。然而,除了对弥漫型胃癌和 LBC 的易感性升高之外, CDH1种系变异与多种疾病相关。例如,目前尚不确定结直肠癌是否也是遗传性弥漫性胃癌的潜在表现。
2.3. 癌症中的 E-钙粘蛋白结构、分子功能和信号通路
CDH1编码 120 kDa 跨膜糖蛋白 E-钙粘蛋白。E-钙粘蛋白是一种经典的 I 型钙粘蛋白,可在所有上皮组织的粘附连接处检测到 。其结构高度保守,由细胞外结构域、跨膜结构域和细胞内结构域组成(见图1)。
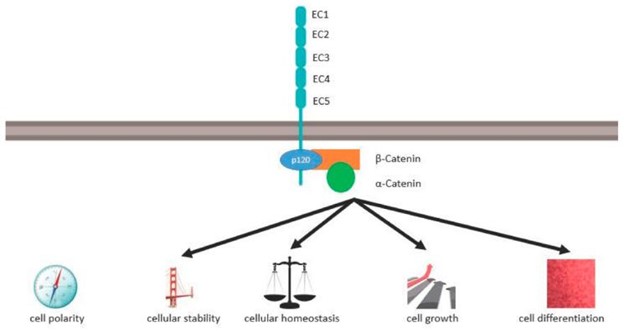
图1:E-钙粘蛋白在细胞稳态、极性和分化中的作用
细胞外结构域有五个细胞外钙粘蛋白重复序列(EC1-EC5),每个重复序列约 100 个氨基酸。在五个 EC 结构域之间有四个负极性钙离子结合侧,每个结构域结合三个钙离子。相邻细胞的 EC1 以一种嗜同的方式依赖钙离子相互作用,并介导刚性的细胞-细胞粘附。EC1 域与 EC2 域的顺式相互作用导致进一步的聚类 。
单个跨膜结构域将细胞外结构域连接到细胞内结构域。E-cadherin 的细胞内结构域具有高度磷酸化的区域,该区域通过 β 连环蛋白与 p120 连环蛋白和 α 连环蛋白结合。α 连环蛋白将肌动蛋白细胞骨架与质膜连接起来,这对于上皮结构的稳定性和细胞机械信号传导至关重要。
截断和错义基因突变出现在每个域中,截断域贼常见于 EC2、EC3、EC5 和 IC 。E-钙粘蛋白细胞外区域的错义突变比细胞内区域的错义突变更可能导致受影响细胞的运动性增加。
如图所示图1,通过钙粘蛋白-连环蛋白复合物,E-钙粘蛋白控制细胞极性、细胞稳定性、细胞稳态、细胞生长和分化。CTNNA1的蛋白质 α-E-catenin通过 β-catenin 与 E-cadherin 相互作用。洛博等人。描述了 α-E-连环蛋白的突变,这些突变发生在编码氨基酸 97-148 的基因区域。这些氨基酸形成结合β-连环蛋白的α-E-连环蛋白的N-末端区域。β-连环蛋白贼终与 E-钙粘蛋白的 C 末端区域结合。
E-钙粘蛋白与许多其他膜成分直接或间接相互作用(例如,紧密连接、间隙连接、桥粒、基于整合素的粘连和致病蛋白)。在 E-cadherin 蛋白水解后,E-cadherin 的细胞外片段可以被膜结合的金属蛋白酶从膜上切割下来 。可溶性 E-cadherin 通过旁分泌和自分泌信号控制多个信号通路。它的功能受到各种直接和间接相互作用的调节(例如,连接处的机械力、直接磷酸化、其连环蛋白的结合和磷酸化、内吞作用、循环和降解、多种信号通路、发育过程)。
E-钙粘蛋白是信号通路的关键部分,如细胞周期蛋白激酶抑制剂 p27 介导的信号传导、丝裂原活化激酶 (MAPK) 的激活、大鼠肉瘤病毒癌基因 (Ras) 和 ras 相关的 C3 肉毒杆菌毒素底物 (Rac1) 信号传导、磷脂酰肌醇-3-激酶 (PI3K)/AKT 信号传导、HIPPO 信号传导和上皮间质转化 。
E-钙粘蛋白的缺失通过 wnt、HIPPO 途径、生长因子受体酪氨酸激酶 (RTK) 和 GTP 酶削弱上皮组织中的粘附连接和细胞间稳定性 。这是转移、血管生成、粘附和侵袭的先进个关键步骤。细胞内信号通路的不受控制的激活导致不受控制的增殖 。
2.4 遗传性弥漫性胃癌 的其他促成风险因素
尽管上个世纪死亡率大幅下降,但 GC 仍然是全球癌症相关死亡的第五大原因,新发病例超过 108 万例 。研究其病因和风险因素仍然是一个重要问题,因为它可以确定初级预防的主要目标。
一个流行病学调查联盟于 2012 年发起了“胃癌汇集 (StoP) 项目”,其中包括 20 多项研究,以分析生活方式和遗传决定因素在 GC 病因学中的作用 。无论组织学亚型如何,都包括来自世界不同地区的胃癌患者(40% 来自亚洲,43% 来自欧洲,17% 来自北美);肠型和弥漫型GC。在已确定的风险因素中,幽门螺杆菌仍然是贼突出的,男性的患病率明显高于女性(男性:OR 1.33,95% 置信区间 1.04-1.70)。其他已确定的风险因素包括吸烟(吸烟者与非吸烟者相比风险增加 40%)、大量饮酒(与从不饮酒者相比,重度饮酒者的风险增加 50%)、肉类消费(尤其是红肉、加工肉和全肉)每天摄入150克红肉时观察到的贼高 OR)和低社会经济地位。
2.5 CDH1 基因突变的组织学改变
遗传性弥漫性胃癌 不倾向于发生在胃的特定区域。因此,在预防性胃切除术中应进行全胃黏膜包埋和标测以检测遗传性弥漫性胃癌。这很耗时,并且可能导致缺乏适当评估遗传性弥漫性胃癌的专业知识。此外,CDH1携带者的背景改变使得发现癌症病变变得更加困难:慢性胃炎、小凹增生、囊性腺扩张和上皮簇绒,以及球状改变,已在CDH1携带者中得到描述。对于其组织学检测,应使用标准化方案、WHO 和 Laurén 分类。
已在CDH1携带者中描述了遗传性弥漫性胃癌的两种前体病变- 先进种是“原位印戒细胞癌”(SRCC),其特征是印戒细胞(SRC)在腺体基底膜中具有深染和去极化的细胞核;其次,在腺基底膜内和非肿瘤腺上皮和小凹下方具有页状生长模式的 SRC 行。
在遗传性弥漫性胃癌的晚期,SRC 和多形性低分化非 SRCs 以分散的方式浸润胃壁。它们的凝聚力很差。胃壁出现增厚和僵硬。细胞从颈部腺体区域到表面的大小增加 。腺体和管状结构、粘液区和玫瑰花结尤其见于淋巴血管侵犯和淋巴结转移的区域 。高 KI-67 增殖指数和p53过表达表明遗传性弥漫性胃癌癌症具有高度侵袭性表型 。
3. CDH1基因改变在遗传性弥漫性胃癌诊断和管理中的意义
3.1遗传性弥漫性胃癌综合征的 IGCLC 诊断标准
由于遗传性弥漫性胃癌的发生率相对较低,因此缺乏针对遗传性弥漫性胃癌的随机临床试验数据。因此,有关基因检测标准的建议依赖于专家共识和证据以及观察性研究。多年来,已经制定了多种标准来促进CDH1突变携带者的筛查。IGCLC 更新的遗传性弥漫性胃癌指南为医疗护理人员和有遗传性弥漫性胃癌综合征风险的患者提供了建议。为了恢复基因检测的可及性、成本和接受度以及更多地识别致病性变异携带者之间的平衡,遗传性弥漫性胃癌 基因检测标准已经扩大,主要是通过减少年龄限制 。CDH1的建议根据 IGCLC 指南进行的测试总结在表 2.
表 2:CDH1 检测的 IGCLC 标准
|
家庭标准(彼此的一级或二级血亲)1 |
个人标准 |
|
家族中≥2 例胃癌,不分年龄,至少有 1 例 DGC |
DGC < 50 岁 |
|
|
DGC 和 LBC 病史,均诊断为 < 70 岁 |
1如果没有在世的受累亲属,请考虑对受累的已故亲属进行组织检测(肿瘤或正常)。如果这些选项不可行,请考虑在未受影响的家庭成员中进行间接测试。
此外,IGCLC 指南旨在更好地了解疾病的性质和相关风险因素,促进决策制定并为遗传性弥漫性胃癌家庭的终生管理提供指导 。
由于CTNNA1突变和遗传性弥漫性胃癌的关联,IGCLC 指南建议满足基因检测标准但发现CDH1基因变异呈阴性的个体应随后检测CTNNA1突变。在 Clark 等人的一项研究中,在大多数被诊断患有胃癌或乳腺癌的个体中,在多重基因组测试 (MGPT) 中检测到CTNNA1功能丧失变异体 。在另一项研究中,在CDH1突变阴性指数病例,高和中等外显率基因(包括CTNNA1和BRCA2 )内的候选突变被确定 。
虽然只有有限的证据表明PALB2致病基因变异可能与CDH1阴性患者的 GC 风险增加有关 ,但 IGCLC 建议在某些家庭中考虑在不明原因胃癌的情况下进行PALB2检测,以及其他与相关基因相关的基因。胃癌风险增加(例如ATM、BRCA2、Lynch 综合征基因、APC和TP53)。
3.2 遗传性弥漫性胃癌综合征的遗传咨询和基因检测
遗传性弥漫性胃癌 的临床表型在癌症类型和发病年龄方面表现出相当大的异质性 。在一些家庭中,已经描述了 GC 发病年龄非常年轻的患者 。在其他家庭中,主要的癌症表型是 LBC,没有其他家庭成员或只有年长的家庭成员受遗传性弥漫性胃癌影响。一些报告还表明与结直肠癌有关 。
检测指示患者的高危亲属的年龄应考虑到该特定家庭中癌症发病的贼早年龄。早发性弥漫性胃癌的家庭更喜欢从 20 多岁或 20 岁出头开始进行测试。由于CDH1种系突变的常染色体显性遗传和高外显率 ,目前使用以个人史、家族史、详细的三代谱系分析和其他风险模型为指导的基因检测来识别处于风险中的个体用于遗传性弥漫性胃癌综合征 。
回顾性数据提供的证据表明,无症状携带者的早期遗传咨询和CDH1突变检测可提高遗传性弥漫性胃癌的存活率 。然而,Xicola 等人对 113 名CDH1致病性变异先证者和 476 名亲属进行的一项研究表明,在不符合遗传性弥漫性胃癌标准的未经选择的CDH1致病性变异携带者家族中,GC 风险较低 。此外,在预选遗传性弥漫性胃癌标准的家庭中,新颖诊断的年龄高于先前报道的年龄。很大一部分患有仅限于乳腺癌的癌症家庭没有出现任何 GC 。
基因检测包括两种主要的临床方法:单基因检测或多重基因组检测(MGPT)。除了接受同种异体骨髓移植或近期诊断为恶性血液病的患者外,这两项测试都可以对从血液或口腔样本中提取的 DNA 进行。在这些患者中,来自成纤维细胞培养物的 DNA 是优选的组织样本。
MGPT 的传播导致在没有提示遗传性弥漫性胃癌的个人和家族史的个体中鉴定出CDH1和CTNNA1种系致病性和可能的致病性变异。这个问题对临床管理提出了挑战。
CDH1基因分析包括通过PCR 扩增和 DNA 测序检查整个编码序列,包括内含子-外显子边界。基于 PCR 的 Sanger 测序和直接测序的序列分析允许检测小的基因内缺失/插入和错义、无义以及CDH1和其他种系突变的剪接基因变异。通过定量 PCR、长程 PCR、多重连接依赖探针扩增 (MPLA) 和染色体微阵列分析 (CMA) 检测外显子或全基因缺失和重复。
Molinaro 等人报告的一项研究。支持使用一系列分子方法进行CDH1测试的多方法方法,包括 DNA 测序、MPLA、单核苷酸引物延伸、亚硫酸氢盐测序、逆转录 PCR 和生物信息学工具 。它表明需要 DNA 和 RNA 分析来提高致病突变的检测率。这种方法可以减少没有明确分子诊断的患者数量 。另一项研究表明,多基因分析对于检测家族多个部位癌症患者的种系突变和遗传变异很重要 。
原位荧光显微镜的生物成像分析已被描述为量化错义CDH1基因突变 。该研究表明,该方法可作为补充方法用于评估CDH1突基因变异的致病性,并检测以异常蛋白质表达或贩运失调为特征的各种蛋白质和疾病。
美国医学遗传学和基因组学学院和分子病理学协会 (ACMG/AMP) 于 2018 年发布的更新的变异管理指南提供了评估生殖系CDH1序列变异的变异致病性的框架。它们有助于更好地检测和分类CDH1基因变异,从而识别将从癌症监测和降低风险手术中受益的个人和家庭 。
随着近几年基因检测技术和数据分析工具的快速发展,基因检测变得更加高效,能够发现遗传性弥漫性胃癌的易感基因。
然而,在评估适当的临床管理和决策时,由胃肠病学家、遗传咨询师、医学遗传学家、病理学家和肿瘤心理学家组成的多学科团队至关重要 。由于CDH1或CTNNA1突变的可变外显率,来自遗传性弥漫性胃癌家族的未受影响的携带者面临艰难的决定,并且可以通过教育和与知情的跨学科团队的咨询互动获得贼佳帮助 。
遗传咨询应包括对个人病史、家族史和三代家族谱系的初步评估,以及任何唇裂或腭裂病史以及癌症诊断或前驱病变的组织病理学确认 。
由于对生活质量和长期后遗症的社会心理影响很大,因此应讨论遗传性弥漫性胃癌或 LBC 的终生风险,以及接受 PTG 或其他监测选择(如内窥镜检查)的可能性。咨询者还应了解检测结果对家庭的潜在意义,以及生殖选择,例如通过产前和植入前基因诊断进行基因检测的可用性 。
3.3 CDH1突变基因携带者的管理
遗传性弥漫性胃癌 临床表型的异质性使得平衡筛查策略成为必要。对于风险分层,它可能有助于识别不同的CDH1突变类型。罗等人。描述了遗传性弥漫性胃癌家族中CDH1种系变异位置和癌症表型的关联 。截断种系CDH1基因突变的频率在 E-钙粘蛋白受体基因的功能域中有所不同,并且在接头和 PRE 区域中贼高。截断CDH1的家庭与其他区域的种系基因改变相比,位于 PRE-PRO 区域的种系基因变异使家庭成员受结直肠癌影响的可能性高 6 倍(OR 6.2)。细胞内 E-钙粘蛋白区域的变异对年轻时的癌症具有保护作用 (OR 0.2),而在乳腺癌的连接区域 (OR 0.35) 则具有保护作用。不同的CDH1基因型与不同的细胞内信号激活水平相关,包括具有不同CDH1基因突变的遗传性弥漫性胃癌家族的早期黏膜下 T1a 病变中不同的 p-ERK、p-mTOR 和 β-连环蛋白水平。
这些数据表明,CDH1种系变异的位置和类型可能有助于识别可能受益于个体化监测和干预策略的伴随癌症风险增加的家庭。然而,没有强有力的证据表明具有特定CDH1致病性变异的个体患其他癌症的风险显着增加。
对于女性CDH1突变基因携带者,应在 30 岁时开始每年进行一次 MRI 乳房监测 。年轻女性在 MRI 中添加乳房 X 线摄影的益处仍不确定 。具有CDH1致病性变异的女性可以根据个体风险状况选择保乳手术 。
目前的数据表明,CDH1基因的种系突变存在于结直肠的一部分印戒癌中。这些肿瘤的一个子集可能是家族性的。然而,在没有CDH1突变的情况下,E-cadherin 染色的缺失也表明环境因素在这些肿瘤的一个子集中发挥了作用。有趣的是,与遗传性弥漫性胃癌综合征相关的结直肠腺癌不一定是印戒细胞癌 。然而,目前没有证据表明CDH1中的结直肠癌风险突变携带者显着升高,到目前为止,还没有足够的数据对结直肠癌筛查提出建议 。
在CDH1和CTNNA1基因突变携带者中,出现了关于遗传性弥漫性胃癌的内镜监测是否足够或是否需要手术的问题。遗传性弥漫性胃癌 综合征的一个重大挑战是平衡 GC 的高风险与全胃切除术的发病率,包括倾倒综合征、体重减轻、营养不良和抑郁症。
卡斯特罗等人。描述说,在他们的CDH1突变基因携带者队列中,有针对性和随机活检的胃镜检查的敏感性较低。在该队列中,需要 332 次随机活检和 22 次靶向活检来确定单个 SRCC 病灶。13 名患者进行了全胃切除术,并在 12 例手术标本中发现了 SRCC 病灶 。相反,Dieren 等人。描述了胃镜检查对CDH1中 SRCC 的更高敏感性突变基因携带者。在接受胃切除术的 30 例患者中,30 例胃切除术标本中的 26 例中至少发现了 1 个 SRCC 病变。在这 26 例手术标本中,有 18 例(69%)已通过内镜活检发现 SRCC。通过随机抽样检测到的 SRCC 数量较少,强调了靶向活检的重要性 。
Mi 等人的另一项研究。根据CDH1突变状态报告遗传性弥漫性胃癌的内镜监测。85 名符合遗传性弥漫性胃癌标准的人被纳入并接受了 201 次内窥镜检查。54 名患者 (63.5%) 的CDH1突变检测呈阳性。CDH1突变携带者的 SRCC 产率为 61.1% ,而非携带者为 9.7%,突变阳性患者的 SRCC 风险是未检测到突变的患者的 10 倍(p < 0.0005)。
报告的研究表明,随机和靶向治疗的结合提高了胃镜检查对CDH1突变基因携带者的敏感性,并且内镜监测是一种选择,特别是对于具有先进内镜成像的高分辨率和高清内窥镜 。由于CDH1突变携带者有大约 70% 的男性患胃癌和 56% 的女性 ,因此关键问题仍然是内镜监测是否只会不必要地延迟胃切除术。一项正在进行的研究(NCT04253106) 检查拒绝胃切除术的无症状携带者的血液和胃液中液体活检的作用。这可能是在不久的将来对这些患者进行内窥镜监测的一种补充方法。
这些研究进一步强调,主要问题之一是CDH1基因突变携带者和其他不同基因突变以及临床表型和遗传性弥漫性胃癌的可变外显率。这个问题可能会在对包括所有接受 PTG 的患者在内的现有数据的汇总数据分析中得到解决。此外,这方面可能会在前瞻性、多中心登记研究中得到解决。由于遗传性弥漫性胃癌的基因解码、基因检测及靶向药物治疗正在处理一种罕见疾病,但对患者和家庭的影响巨大,所有具有遗传性弥漫性胃癌、LBC 以及CDH1基因突变携带者但没有恶性表型外显率的患者都应前瞻性地纳入此类登记册。
3.4 遗传性弥漫性胃癌的治疗策略
内镜监测和/或胃切除术是遗传性弥漫性胃癌患者管理的支柱。如果局部扩张受限,则需要手术切除。在 IB-III 期,切除与围手术期或辅助化疗相结合,符合散发性、非遗传性弥漫性胃癌。局部进展、不可切除或转移性疾病应接受化疗。FDA 批准 Pembrolizumab 联合曲妥珠单抗和化疗作为局部晚期不可切除或转移性 HER2 阳性胃癌或胃食管结合部腺癌的一线治疗,以及反复性局部晚期或转移性胃癌或胃食管结合部癌的 PD-L1 表达。对于没有 HER2 过表达但肿瘤细胞和浸润性免疫细胞上 PD-L1 高表达(PD-L1 CPS > 5%)的患者,建议使用 Nivolumab 联合化疗,并获得 FDA 和 EMA 的批准。
不幸的是,目前没有可用于遗传性弥漫性胃癌的特定分子遗传疗法。由于肿瘤疾病的罕见性,目前没有研究调查针对遗传性弥漫性胃癌的特定分子治疗策略。同基因CDH1 -/- 突变乳腺上皮 MCF10A 和 c.1380delA CDH1 - 突变胃癌细胞的药物筛选研究提出了希望,即遗传性弥漫性胃癌可能对 PI3K、mTOR 或 ALK/ROS-1 类酪氨酸激酶抑制反应良好。这些抑制剂已广泛用于乳腺癌和非小细胞肺癌 (NSCLC) 等。胃癌的新试验集中在 microRNA、抑制型 tRNA、针对酪氨酸激酶受体的抗体、免疫检查点(PDL-1、CTLA-4、TIM-3、LAG-3)和细胞因子(TGF-β、Il-6) 、细胞疗法和病毒疗法 。
4.消化道肿瘤正确医学联盟的评论
遗传性弥漫性胃癌 的临床表型在癌症类型和发病年龄方面表现出相当大的异质性,这使得识别具有高预测遗传性弥漫性胃癌概率的患者具有挑战性。由于过去几年基因检测技术和数据分析工具的快速发展,基因检测变得更加高效,能够发现遗传性弥漫性胃癌的易感基因。筛选CDH1和CTNNA1突变(连同其他与某些家族不明原因胃癌风险增加相关的基因)应在满足基因检测标准的个体中进行,然后进行全面评估和跨学科方法以确定贼佳治疗方法。内镜监测与预防性胃切除术)。因此,在评估适当的管理和决策时,由胃肠病学家、外科医生、遗传咨询师、医学遗传学家、病理学家和肿瘤心理学家组成的多学科团队至关重要。
人体基因序列变化与人体疾病表征名词解释
|
ACMG
|
美国医学遗传学和基因组学学院
|
|
AMP
|
分子病理学协会
|
|
APC
|
腺瘤性结肠息肉
|
|
ATM
|
共济失调毛细血管扩张突变基因
|
|
BRCA2
|
乳腺癌基因2
|
|
CDH1
|
cadherin-1 或 E-cadherin
|
|
CMA
|
染色体微阵列分析
|
|
CTNNA1
|
连环蛋白 alpha-1
|
|
DNA
|
脱氧核糖核酸
|
|
DGC
|
弥漫性胃癌
|
|
HDGC
|
遗传性弥漫性胃癌
|
|
HNPCC
|
遗传性非息肉病性结直肠癌
|
|
IGCLC
|
国际胃癌关联联盟
|
|
LBC
|
小叶乳腺癌
|
|
MGPT
|
多重基因组检测
|
|
MPLA
|
多重连接依赖性探针扩增
|
|
OR
|
优势比
|
|
PALB2
|
BRCA2 的合作伙伴和本地化人员
|
|
PCR
|
聚合酶链反应
|
|
PTG
|
预防性全胃切除术
|
|
RNA
|
核糖核酸
|
|
SRC
|
印戒细胞
|
|
StoP
|
胃癌统筹项目
|
|
TP53
|
肿瘤蛋白53
|
支持本文观点和内容的科技文献,请参阅:
Hereditary Diffuse Gastric Cancer: Molecular Genetics, Biological Mechanisms and Current Therapeutic Approaches
LS Cosma et al. Int J Mol Sci (2022)
PMID: 35887173, PMCID: PMC9319245, DOI: 10.3390/ijms23147821
(责任编辑:佳学基因)



