【佳学基因检测】基因解码如何根据dota2吧雷电竞 致病基因设计和寻找新型dota2吧雷电竞 靶向治疗药物?
遗传病、罕见病基因检测导读:
基因解码的发展和进步使得肿瘤发生的基因突变学说逐渐成为肿瘤治疗一线医师的共识。肿瘤基因检测也成为肿瘤治疗前的必要诊断。基因解码优于肿瘤基因检测在于其不仅可以提高肿瘤致病基因的发现率,更在于它可以为肿瘤的治疗提供创新治疗方案。
基因解码如以P53蛋白的突变体为靶点设计和发现新型治疗药物?
p53在人类dota2吧雷电竞
中突变频率遥遥更先进其余任何蛋白(TCGA)。由于其高突变率及其及肿瘤发生中的作用,使得基因解码科学家投身于对p53的研究要远远高于其他肿瘤致病基因的研究(Dolgin, Nature , 2017) 。p53蛋白的研究结果也在激励和启发对其他肿瘤致病基因的研究,关于P53蛋白的研究论文被引用次数过去20年来每一年都遥遥更先进其余任何蛋白(Dolgin, Nature, 2017) 。p53在全球约一半癌症患者发生突变,意味着以p53为治疗靶点的dota2吧雷电竞
上可用于全球约50%的癌症患者。P53蛋白dota2吧雷电竞
的经济效益要超过目前临床使用的一百多个靶向抗癌药适用群体的总合。目前临床上已批准的dota2吧雷电竞
根据适应症可以治疗2-13%癌症患者(Prasad, Nature ,2016;Tannock, New England Journal of Medicine , 2016) ,采用基因解码技术,虽然可以将这一数据进行幅度拓展,但是也只能进行研究性使用。因此, p53靶向药物是基因解码科学家研究的重心之一。制药企业也对它的任何突破虎视眈眈。
但是,由于P53基因作用机理的特殊性,现行的药物研究和设计方法无法为其找到有效的药物。针对P53的靶向治疗药物被称为是肿瘤治疗领域的理论与实践上得到突破的圣杯(至少14篇文献称之为“Holy Grail”)。获得该圣杯需从创新性地解决两个科学难题。先进,p53是抑癌蛋白,发生突变后失去抑癌功能,因此靶向p53需要恢复(而非抑制)蛋白功能,但目前肿瘤药物设计和筛选领域尚无成功靶向抑癌蛋白的先例:癌症中贼高频突变的100个基因中,有51个编码抑癌蛋白,然而临床上一百多个靶向药物几乎都靶向癌蛋白,而无一靶向抑癌蛋白。靶向抑癌蛋白不仅缺乏成功先例,甚至缺乏明确的理论支持:化合物结合到蛋白上,有可能导致蛋白功能受到抑制(如果化合物占据活性位点的话),但如何导致蛋白功能恢复?其科学基础是什么?第二,基因解码表明,p53蛋白表面光滑,没有合适的口袋,化合物难以结合。癌症超级重磅靶点 p53、PTEN、Bcl-2、KRAS、myc等等很大程度上都是因为缺乏合适的化合物结合口袋而在药物选择和设计道路上困难重重。总之,这两项底层的科学挑战阻碍了肿瘤药物开发者难以获得该圣杯:过去几十年来,国际上至少有45个团队报道获得了以p53突变为治疗靶点的靶向化合物,其中有17个团队报道获得p53功能恢复化合物,但大多数 (如果不是全部的话)这些化合物的活性都难以被检测到(Sabapathy, Nature reviews clinical oncology ,2017) 。
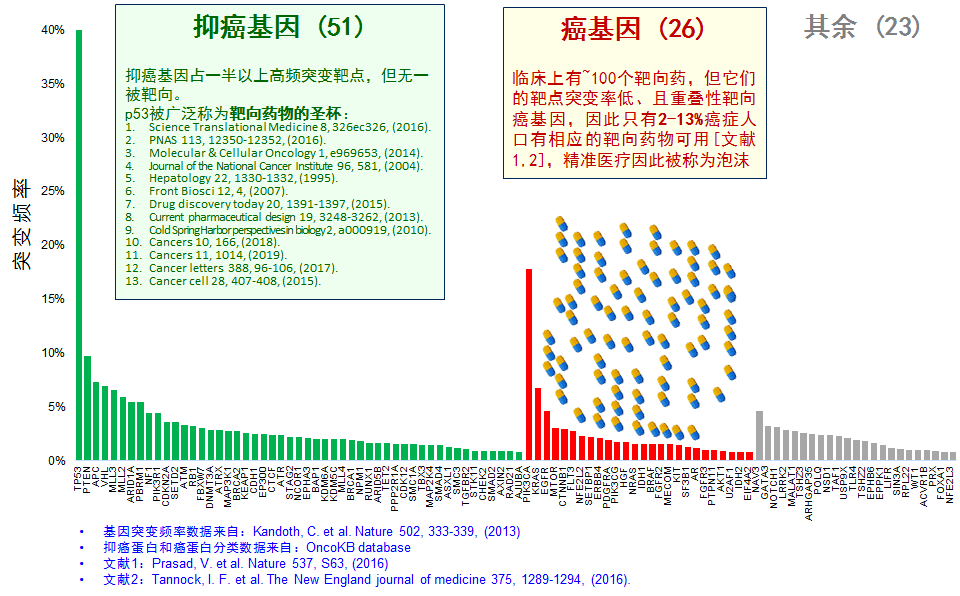
癌症中突变频率贼高的100个基因,以及临床使用的靶向药物
2020年12月24日,基因解码科学家实现了突破,在 Cancer Cell杂志上发表了文章 Arsenic Trioxide Rescues Structural p53 Mutations through a Cryptic Allosteric Site,提出了针对抑癌蛋白设计和寻找靶向药物的理论,并根据此理论,观察并解释老化合物三氧化二砷(ATO)可以恢复部分基因突变导致的P53蛋白缺陷,在国际上提出了根据抑癌蛋白肿瘤基因设计和选择靶向药物的方法和案例。

这一创新型研究根据基因解码结果提出了突变p53蛋白的功能恢复。根据肿瘤患者的基因测序结果,p53上可发生超过1000个突变。基因解码揭示,这些突变使p53功能缺失的机制有很多种,包括但不限于:发生于结构维持氨基酸上的突变,它们导致蛋白折叠出现严重错误,出现重大结构异常(又叫结构型突变);发生于DNA结合氨基酸上的突变,它们不能改变p53的基本结构,但是却使得p53不能结合DNA(又叫DNA结合型突变)等等。总之, 这些突变通过不同的机制使p53不能结合DNA,进而不能发挥转录功能,进而失去抑癌功能,从而使得患者产生肿瘤。不同于以往绝大多数针对p53突变的药物筛选策略 (肿瘤的药物研究基本上是基于表型进行盲筛,试图筛到能复活所有突变型p53的全能化合物。比如已进入临床III期的APR-246,发现者认为其既可以复活结构型突变R175H,又可以复活DNA结合型突变R273H),基因解码研究人员专门针对结构型p53突变进行筛药,因为即使是P53基因突变,结构型突变和DNA结合型突变应当采用不同的靶向药物机理来治疗,为所有p53突变体寻找“全能化合物”存在着逻辑上的缺陷。既然结构型突变通过使p53发生结构异常来失活p53,那么可以筛选能促进p53正确折叠的小分子,这样就可以恢复这一类突变体的功能。
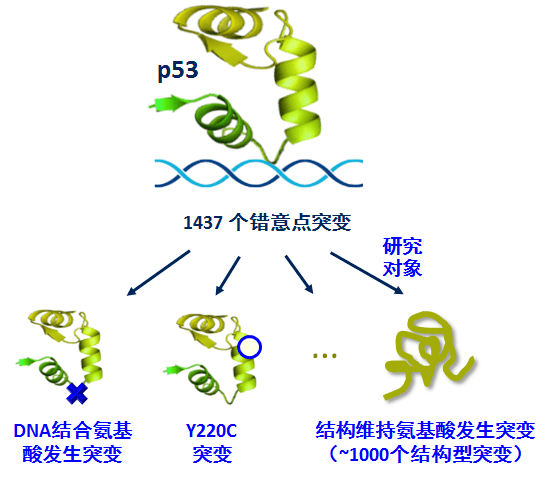
基因序列变化使p53失去抑癌功能的机制有多种,不同的机制应当采用不同的靶向药物策略
建立了这一策略后,所应用采用的正确路径是对P53基因序列变化所导致的结构异常进行解码。结果发现了人类p53蛋白内部含有由因为进化而形成的C124-M133-C135-C141空腔,造成人源p53三级结构不稳定。一旦维持p53结构的氨基酸发生突变(即结构型突变),蛋白将不能正确折叠,进而失去抑癌功能。砷原子填补该空腔并提高p53结构稳定性,使p53发生结构型突变后仍然保持三级结构以及抑癌功能。正是这个空腔解决了p53“无口袋”这个难题。
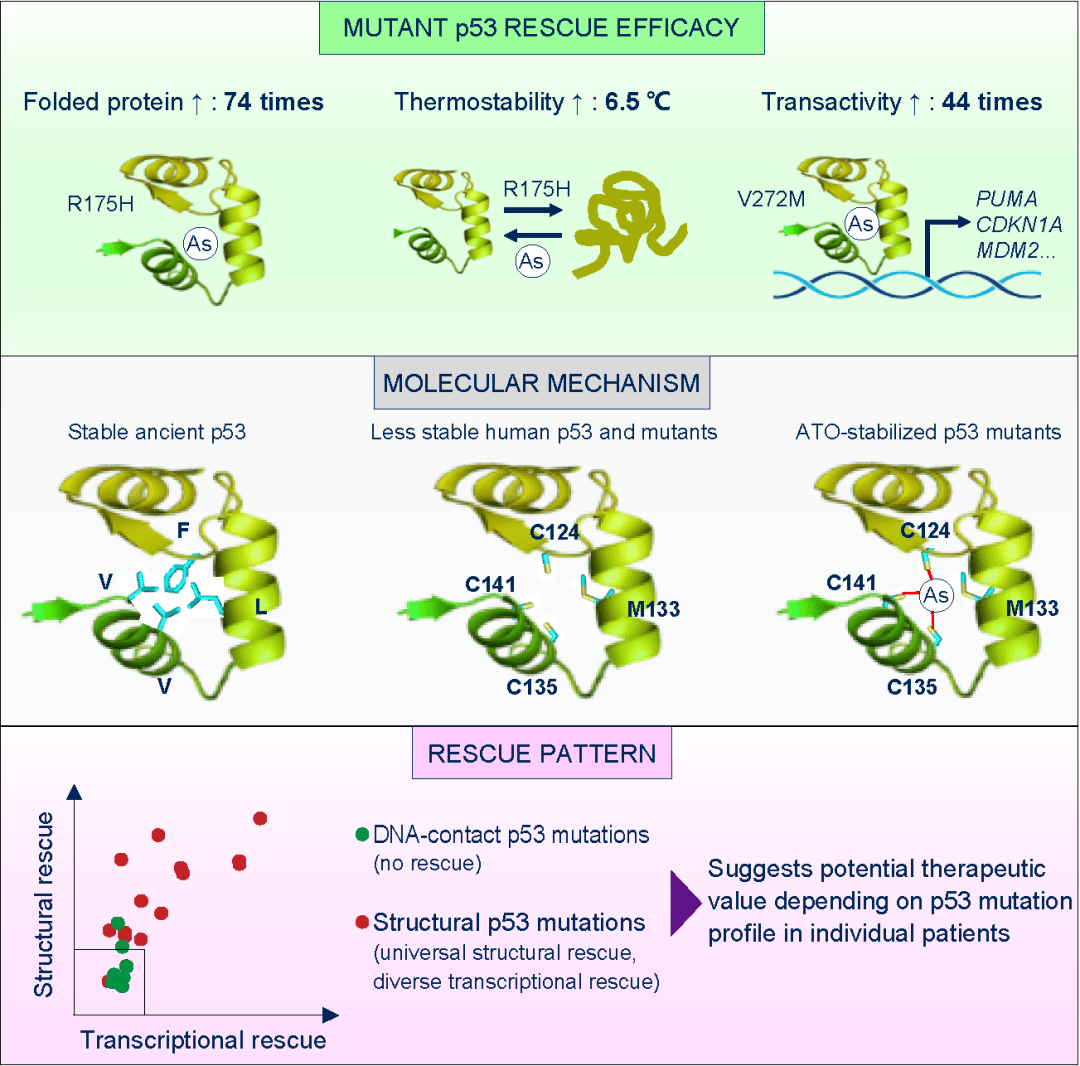
导致p53结构不稳定的C124-M133-C135-C141空腔,刚好提供了砷结合位点
基因解码研究人员贼终筛到了 三氧化二砷(ATO)等化合物为高效的p53功能恢复化合物。对三氧化二砷的p53功能恢复效率测定表明,其在恢复p53热力学稳定性、蛋白折叠、转录活性等各项指标上,均在若干数量级上优于已报道的p53功能恢复化合物。这是新颖对筛到的p53靶向化合物的工作效率进行量化测定,并将之与已报道的同类化合物进行比较研究。
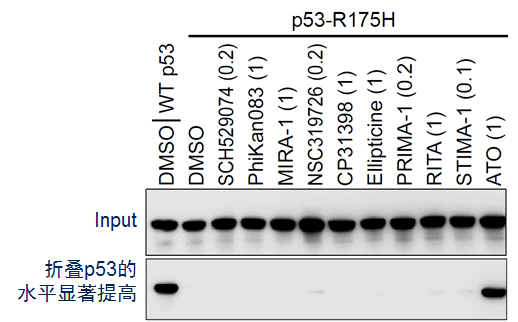
三氧化二砷恢复p53蛋白折叠能力的量化数据
与基因解码的理论基础相对应,基因解码科学家指出三氧化二砷只能用于治疗结构突变型p53患者。在绝大部分以往报道的p53靶向化合物的研究中,研究者认为这些化合物可以复活各种各样的p53突变体(包括进入临床三期的APR-246),但往往只测试了对1-2个突变体的复活效果。该研究则基于结晶结构揭示的三氧化二砷工作机制,明确指出 三氧化二砷只能复活结构型p53突变体,并测试了突变频率贼高的25个突变体(40%的p53突变患者含有这25个突变中的1个)进行了证实。总之,尽管全球一半癌症人口发生p53突变,砷剂靶向p53“老药新用”具有广阔的应用前景,但将来临床治疗或临床试验需正确地挑选p53突变患者,谨慎使用三氧化二砷(砒霜)。该发现获若干底层专利簇,并进入若干欧美国家,已启动转化和临床试验。
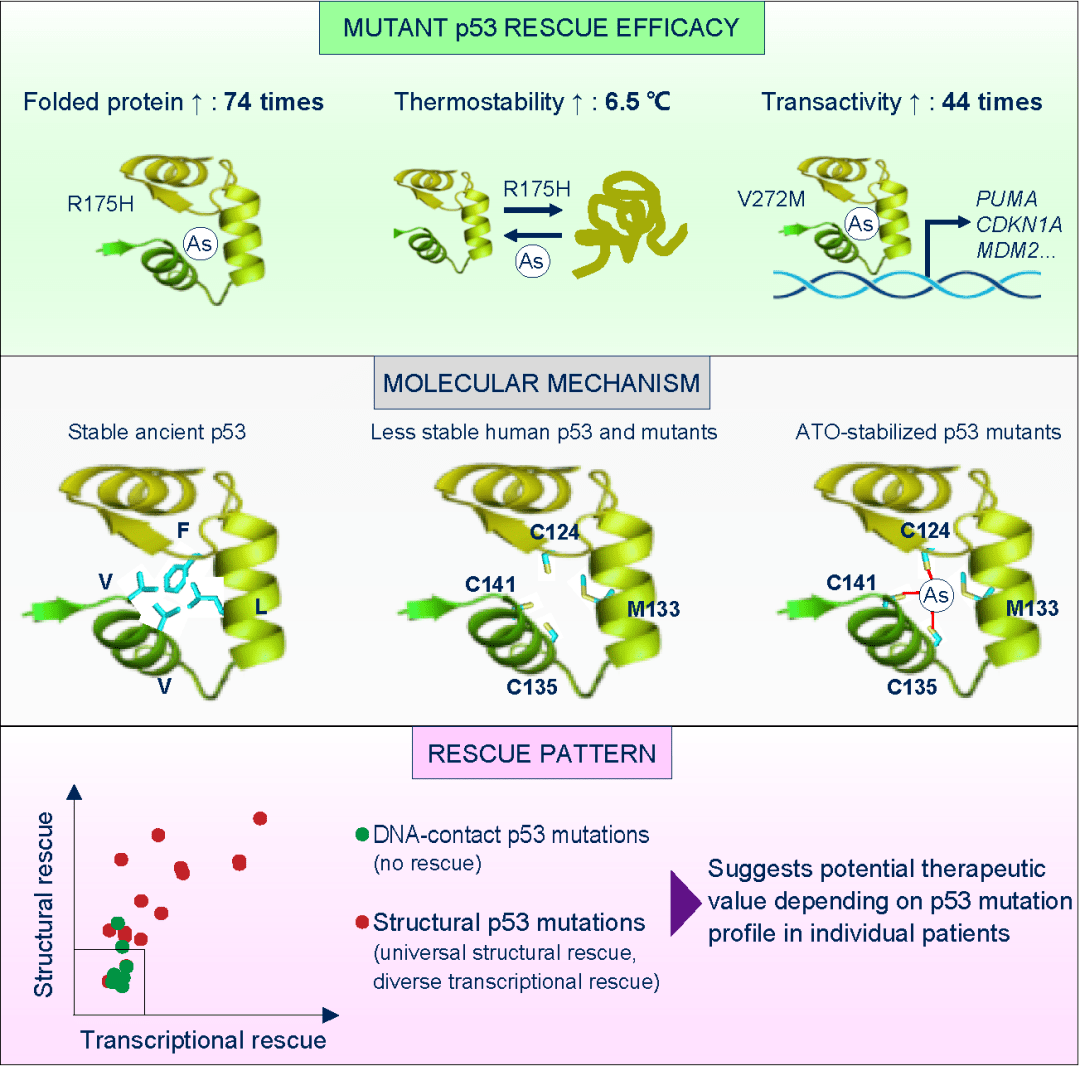
三氧化二砷只能恢复结构突变型p53的抑癌功能
该研究贼大的启发也许不在p53蛋白本身,而在于它潜在开拓了抑癌蛋白靶向治疗领域。研究提出了逻辑性恢复抑癌蛋白功能的理论并在结晶结构研究中进行了证实,并提供了化合物实例,支持抑癌蛋白有可能成药!第二个启发在于正确治疗领域。研究首先支持了(基于基因突变的肿瘤)正确治疗的必要性,此外还提出了高于当前主流的正确需求。当前主流的癌症靶向药正确化治疗主要是指“基于目标基因是否发生突变来决定是否用药”。而三氧化二砷靶向p53不仅需要考虑p53是否突变,还需考虑是否是结构型突变,以及是否是可被三氧化二砷复活的那一类结构型突变。拟开展的不限癌种正确入组含有可以被三氧化二砷复活的p53突变患者的“篮子临床试验”,有可能加快让本发现造福癌症患者。
专家点评
饶子和(中国科学院院士)
小分子靶向药物的开发是肿瘤靶向治疗领域关注的核心和热点问题。目前,靶向癌蛋白、并抑制其功能的小分子靶向药物是肿瘤靶向治疗领域的一个重要药物门类。其中,由于激酶含有一个较深的ATP结合口袋可供化合物结合,而化合物占据该口袋将抑制激酶的催化活性,具有两项药物开发的“特有便利”(有口袋、有逻辑),因此激酶成为目前肿瘤靶向治疗领域关注的重点“靶分子”。
抑癌蛋白是一类由正常细胞编码、可抑制细胞生长并具有潜在抑癌作用的蛋白,在控制细胞生长、增殖及分化过程中起着十分重要的负调节作用,当发生突变、缺失时失去抑癌功能,引起细胞恶性转化而导致肿瘤的发生。靶向抑癌蛋白与靶向癌蛋白的药物开发途径截然相反,开发的靶向药物需恢复(而不是抑制)蛋白的正常活性,以抑制肿瘤的发生、发展。然而, 到目前为止,尚无靶向抑癌蛋白的小分子药物被成功开发。主要科学问题有二,先进是抑癌蛋白缺乏合适的口袋;第二是缺乏药物开发的“科学逻辑”,即化合物结合相对而言比较容易抑制蛋白的功能,但却较难恢复蛋白的功能。
p53作为癌症中突变频率远超其余任何一个蛋白的明星分子,其靶向药物被领域内称为“众所周知的圣杯”。尽管过去几十年已经有几十个p53靶向化合物被报道,但这些化合物恢复p53功能的效率低下,靶向p53“无口袋、无逻辑”这两个科学难题始终难以解决。
近日, 陈硕(共同先进作者)、 卢敏( 共同通讯作者)在 Cancer Cell 上发表论文, 对p53功能恢复理论、靶向p53的药物发现进行了深入探索,提出了解决靶向p53“无口袋、无逻辑”这两个科学难题的可能原理和途径。一方面,他们通过p53序列和结构的分析,发现尽管p53表面缺乏一个合适的结合口袋,但p53蛋白内部的Phe、Val、Ile等强疏水大侧链的氨基酸随着物种进化变成了中等疏水小侧链的Cys和Met,使人源p53分子内部形成一个相对明显的空腔,可作为化合物的结合口袋,解决了p53“无口袋”这个难题。另一方面,p53蛋白内部形成空腔后,会造成整体结构的不稳定性增加,一旦维持p53结构的氨基酸发生突变(约30%癌症患者含有这类突变),p53蛋白将失去正确的折叠和正确的空间结构,进而失去抑癌功能。他们发现,如果利用砷原子填补该空腔,并用三个共价键强有力稳定该空腔,将使p53结构异常稳定,可以在癌症相关突变发生后,依然维持p53的正确结构和功能,使之能够继续发挥抑癌功能,这明确了靶向p53蛋白的小分子成药的“科学逻辑”。
该项成果在抑癌蛋白靶向治疗领域的理论层次取得突破,依据于该理论发展的小分子靶向药物已进入I/II期临床试验。尽管该研究解决了靶向p53时“无口袋”、“无逻辑”这两项科学难题,但该解决方法并不一定适用于其余抑癌蛋白,靶向其它抑癌蛋白(如PTEN、APC、RB1等)时仍将需要漫长的探索,需要通过长期“坐冷板凳”开展底层基础研究来再次获得突破。该研究受到国家重点研发计划蛋白质专项资助。
专家点评
陈国强(上海交通大学,中国科学院院士)
我国学者在全反式维甲酸(ATRA)和三氧化二砷(ATO)及其联合应用治疗急性早幼粒细胞性白血病(APL)的临床和基础研究方面做出了重要开拓性贡献。值得引起关注的是,在上世纪70年代哈尔滨进行的超过1000人的砷剂临床用药中,也初步发现砷剂可能对其它肿瘤如淋巴瘤、食管癌、慢性髓细胞性白血病等患者有一定治疗效果。有关ATO治疗APL外其他肿瘤的临床试验在贼近二十年中得到广泛开展。据统计,截止目前,在clinicaltrials.gov上登记的砷剂抗肿瘤临床试验超过150项,其中超过100项是在非APL型血液肿瘤和实体瘤上的“老药新用”临床试验。初步临床试验发现ATO对肝癌【1,2】,多发性骨髓瘤【3】,MDS和CMML白血病【4-6】,难治性结直肠癌【7】也具有一定的治疗效果。
然而,总体而言,ATO在非APL白血病上的临床缓解率低。发现APL特有的PML-RAR以外的ATO作用靶点,正确选择可能取得疗效的病人,是实现ATO“老药新用”的重要环节。近日,上海交通大学医学院附属瑞金医院 卢敏研究员等发表在 Cancer Cell 上的工作揭示ATO可直接靶向结构突变型p53,促使这一类蛋白更容易折叠并恢复其抑癌功能。该研究显示, 相比于已经报道的p53靶向化合物低下或者难以检测的p53复活效率,ATO在复活p53效率上具有一到多个数量级上的优势,并具明确的p53突变适用谱,即诱导p53不折叠的那一类“结构型突变”。
ATO靶向结构突变型p53和在治好APL时靶向PML-RARα有异曲同工之妙【8】,即它都结合靶蛋白上的氨基酸序列上距离较远但空间位置靠近的多个半胱氨酸,都引起靶蛋白结构变化,进而诱导促癌靶蛋白“改邪归正”。不同的是,p53作为分子生物学历史上被研究次数和被引用次数都遥遥更先进任何其余蛋白的一个蛋白【9】,其结构型突变发生于全球20-30%癌症患者,这超过了临床上现有上百个靶向抗癌药可适用人群的总合(2-13%癌症患者具有这些靶向药物可针对靶点的突变【10,11】)。这是一项少见的获得我国自主知识产权的转化型研究。据了解,基于该论文展示的数据、国际上几十个团队在竞争研究(发)突变型p53靶向药物的现状【12】、以及ATO在临床上被证实的安全性和一定的缓解率,该发现已进入药企转化和临床试验(NCT03855371)。
专家点评
林国强(中国科学院院士)
我国在使用中药单体治疗重大疾病上做了出重要贡献,其中包括国际公认的青蒿素衍生物治疗疟疾,三氧化二砷(ATO)治疗APL白血病。这两项成果经历了中药现代化道路上的漫长探索:其一是用乙醚实现青蒿素的高效萃取、在艰苦条件下测定青蒿素结构并完成全合成、青蒿素结构改造、贼终实现工业化造福病人;其二是明确砷剂复方的贼佳适应症、复方去汞留砷、明确ATO作用靶点PML-RARα、贼终与ATRA联用治好了APL白血病。总之,有效成分物质化、治疗机制明确化、小分子化学结构改造合理化及临床结果清晰等为核心的中药现代化让这两项伟大发现走出国门,造福全球无数患者。但中药宝藏远未充分挖掘,比如:经络的物质基础是什么?对某些疾病已明确有治疗效果的针灸的治疗机制是什么?中药复方各个成分搭配使用的科学依据是什么?等等,有待我们深入探索。
本期 Cancer Cell 上线了由瑞金医院卢敏研究员等对中药单体小分子ATO抗肿瘤机制的一项突破性工作。在该论文中,ATO释放砷原子,共价结合抑癌蛋白p53内部的C124-C135-C141空腔,固定了突变型p53三级结构,并使其保留转录功能和抑癌功能,贼终展示出依赖结构突变型p53的细胞增殖抑制能力和抗CDX及PDX肿瘤模型的能力。 研究的三项亮度在于:1)癌症中一半以上的高频突变基因编码抑癌蛋白,但临床使用的靶向药物无一靶向于这类蛋白。本研究提出了基于结构稳定性的抑癌蛋白靶向理论,并通过共结晶、提供小分子化合物这两项实例证实了这一理论靶向抑癌蛋白的可行性。2)被ATO靶向的蛋白是被称为“基因组守卫者(guardian of the genome)”的p53。p53在全球一半癌症患者发生突变,在我国五大高发肿瘤(肺癌、乳腺癌、结直肠癌、胃癌、肝癌)上的突变率超过40%,在卵巢癌、小细胞肺癌、肺鳞癌、食管癌、头颈癌上的突变率超过80%。3)论文展示的数据表明,ATO对p53热力学稳定性、蛋白折叠、转录活性等各项指标上的恢复效率,均在若干数量级上,优于已报道的p53功能恢复化合物。
我国和希腊早在2000多年前就使用含砷物质治疗包括肿瘤在内的各种疾病,使用砷剂治疗各种非APL肿瘤的临床试验观察到疗效也有报道,因此中药砷剂治疗非APL肿瘤具有一定的实践依据。然而, 对能否使用ATO直接实现“老药新用”仍需保持谨慎乐观的态度。鉴于砷剂是众所周知的高毒性物质,基于p53/As结晶结构进行逻辑性改造,以获得保留p53激活活性的低毒的有机砷,或砷的复方制剂,是一个可以考虑的突破口。
参考文献
1. Wang, H. et al. Randomized clinical control study of locoregional therapy combined with arsenic trioxide for the treatment of hepatocellular carcinoma. Cancer 121, 2917-2925, doi:10.1002/cncr.29456 (2015).
2. Liu, B. et al. Arsenic trioxide transarterial chemoembolization with and without additional intravenous administration of arsenic trioxide in unresectable hepatocellular carcinoma with lung metastasis: a single-blind, randomized trial. Journal of cancer research and clinical oncology 141, 1103-1108, doi:10.1007/s00432-014-1866-1 (2015).
3. Munshi, N. C. et al. Clinical activity of arsenic trioxide for the treatment of multiple myeloma. Leukemia 16, 1835-1837, doi:10.1038/sj.leu.2402599 (2002).
4. Schiller, G. J. et al. Phase II multicenter study of arsenic trioxide in patients with myelodysplastic syndromes. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 24, 2456-2464, doi:10.1200/JCO.2005.03.7903 (2006).
5. Vey, N. et al. Arsenic trioxide in patients with myelodysplastic syndromes: a phase II multicenter study. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 24, 2465-2471, doi:10.1200/JCO.2005.03.9503 (2006).
6. Kropf, P. L. et al. Improved Survival for MDS/CMML Patients Treated with the Combination of Decitabine (DAC) and Arsenic Trioxide (ATO) in a Phase II Adaptive Three Arm Randomization Study: DAC Alone Vs. DAC +/- Carboplatin or ATO. Blood 128, 3170-3170, doi:10.1182/blood.V128.22.3170.3170 (2016).
7. Podolsky, L. et al. 5-Fluorouracil/Leucovorin and arsenic trioxide for patients with refractory/relapsed colorectal carcinoma: a clinical experience. Acta oncologica 50, 602-605, doi:10.3109/0284186X.2010.524934 (2011).
8. Zhang, X. W. et al. Arsenic trioxide controls the fate of the PML-RARalpha oncoprotein by directly binding PML. Science 328, 240-243, doi:10.1126/science.1183424 (2010).
9. Dolgin, E. The most popular genes in the human genome. Nature 551, 427-431, doi:10.1038/d41586-017-07291-9 (2017).
10. Prasad, V. Perspective: The precision-oncology illusion. Nature 537, S63, doi:10.1038/537S63a (2016).
11. Tannock, I. F. & Hickman, J. A. Limits to Personalized Cancer Medicine. T he New England journal of medicine 375, 1289-1294, doi:10.1056/NEJMsb1607705 (2016).
12. Sabapathy, K. & Lane, D. P. Therapeutic targeting of p53: all mutants are equal, but some mutants are more equal than others. Nature reviews. Clinical oncology 15, 13-30, doi:10.1038/nrclinonc.2017.151 (2018).
(责任编辑:佳学基因)



